रसायन शास्त्र (Chemistry) 
9 September 2020
द्रव्याचे स्वरूप (भाग 1)
28 October 2020
द्रव्याचे स्वरूप (भाग 2)
4 November 2020
अणू संरचना (भाग - 1)
25 December 2020
अणू संरचना (भाग - 2)
8 January 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 1)
28 April 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 2)
13 May 2021
धातू व अधातू
5 September 2021
धातू व अधातूचे रासायनिक गुणधर्म
19 September 2021
मुलांनो, तुम्ही तुमच्या आजूबाजूला नजर टाकलीत तर काय दिसते? खूप वेगवेगळ्या गोष्टी, नाही का? त्याची यादी करता येईल का? मला तर वेगवेगळी झाडे, काही पक्षी, प्राणी, रस्त्यावरून जाणाऱ्या गाड्या दिसत आहेत. घरात सुद्धा लाकडी फर्निचर, काही लोखंडी वस्तू, तांब्या-पितळेची, स्टीलची भांडी, काचेचे ग्लास, कप दिसतात. तुमची यादी वेगळी आणि मोठी सुद्धा असू शकेल. या सर्व वस्तूंमध्ये (शास्त्रीय भाषेत द्रव्यांमध्ये) किती विविधता आहे ना? यातील काही वस्तू सजीव आहेत तर काही निर्जीव, काही नैसर्गिक तर काही मानव निर्मित, काही स्थायूरूपात काही द्रवरूपात तर काही वायुरूपात. ही आपल्या अभ्यासाची सुरुवात. निरीक्षण करणे. आता हे निरीक्षण केल्यावर अभ्यासाचा पुढचा टप्पा.
तुम्हाला हे एवढे वैविध्य का, कसे व कशामुळे असे प्रश्न पडले पाहिजेत. हे एवढे पदार्थ कसे तयार झाले, त्यांचे मूळ काय ते शोधावे असे वाटले पाहिजे. हा प्रश्न तुम्हाला पडला की तुम्ही शास्त्रज्ञांच्याच रांगेत जाऊन बसाल. कारण या पृथ्वीवर जेव्हापासून मानवाचा वावर सुरू झाला तेव्हापासून मानवाला हे प्रश्न पडले आहेत व त्यांची उत्तरे शोधण्याचे प्रयत्न देखील चालूच आहेत.
ऐतिहासिक पार्श्वभूमी
सुरुवातीला सर्व पदार्थ पंचमहाभूतांपासून म्हणजेच पृथ्वी, आप, तेज, वायू व आकाश यापासून बनले आहेत असे वाटत होते. परंतु जशी विज्ञानाची प्रगती झाली तशी ही समजूत चुकीची आहे हे लक्षात आले. म्हणजेच विविध द्रव्ये बनण्यासाठी लागणारी मूळ द्रव्ये वेगळीच असणार हे लक्षात येऊ लागले व ती कोणती हे शोधण्याचे प्रयत्न सुरू झाले. जसजसा काळ पुढे गेला तसतसे सोने, चांदी, तांबे, शिसे यासारखे काही धातू माहित होत गेले. या धातूंवर वातावरणातील घटकांचा फारसा परिणाम होत नाही हे देखील लक्षात आले. त्यानंतरच्या दोनशे वर्षांमध्ये मात्र रसायनशास्त्राच्या अभ्यासात खूपच वेगाने प्रगती झाली. अनेक द्रव्यांचा अभ्यास करून जॉन डाल्टनने त्याचा अणू विषयक सिद्धांत मांडला (इ.स.1803) व असे सांगितले की पदार्थ (द्रव्य) हे अनेक लहान कणांचे बनलेले असतात. या कणांना त्याने ‘अणू’ असे संबोधले.
ज्या द्रव्यांमध्ये असणारी वेगवेगळी द्रव्ये सहजपणे किंवा भौतिक क्रिया वापरून वेगळी करता येतात त्यांना ‘मिश्रण’ म्हणतात तर ज्यातील द्रव्य रासायनिक अभिक्रियांमुळे विघटन होऊन वेगळी होतात त्यांना ‘संयुगे’ तर ज्या द्रव्यांचे भौतिक किंवा रासायनिक अभिक्रिया करून सुद्धा विघटन करता येत नाही त्यांना ‘मूलद्रव्य’ म्हटले जाते.
एका मूलद्रव्याचे लहानात लहान कण एक सारखेच असतात. त्यांचे रासायनिक व भौतिक गुणधर्म ही सारखेच असतात (हे विधान बरोबर आहे का याचा विचार करा.) या मूलद्रव्यांना नावाबरोबरच संज्ञा देण्याचे काम थॉमस थॉमसन याने इ.स. 1801 मध्ये केले. एकदा मूलद्रव्य म्हणजे काय हे समजल्यावर शास्त्रज्ञांची एक फळीच वेगवेगळ्या मूलद्रव्यांचे शोध घेऊ लागली. हे प्रयत्न वेगवेगळ्या देशांच्या प्रयोगशाळेत एकाच वेळी चालू होते. कसा घेतला असेल हा शोध? कोणती साधने वापरली असतील? कोणते गुणधर्म तपासले असतील?असे प्रश्न मनात येतात का? अर्थात त्यावेळी उपलब्ध असणारी साधने वापरूनच हा शोध घेतला गेला असणार. त्यांचे मुख्यत्वे वजन, आकारमान, पाणी, आम्ल आणि आम्लारी यासारख्या अभिकारकांबरोबर होणाऱ्या अभिक्रिया यांचा विचार केला गेला असेल. असेल नाही, तर केला गेलाच. वेगवेगळी उपलब्ध संयुगे तपासली गेली.

जॉन डोबेरायनर
यात असणारी मूलद्रव्ये कशा तऱ्हेने एकमेकांशी जोडली गेली आहेत ते शोधले गेले. यामुळे मूलद्रव्यांच्या संयुजांबद्दल माहिती मिळाली. हळूहळू मूलद्रव्यांची संख्या वाढत गेली. त्यानंतरची पुढली पायरी म्हणजे या वेगवेगळ्या मूलद्रव्यांच्या गुणधर्मात काही सारखेपणा किंवा वेगळेपण आहे हे शोधण्याचा प्रयत्न केला. हे करत असतानाच 1817 मध्ये जॉन डोबेरायनर याच्या असे लक्षात आले की तीन-तीन मूलद्रव्यांच्या काही गटांमध्ये रासायनिक दृष्ट्या साधर्म्य आहे.
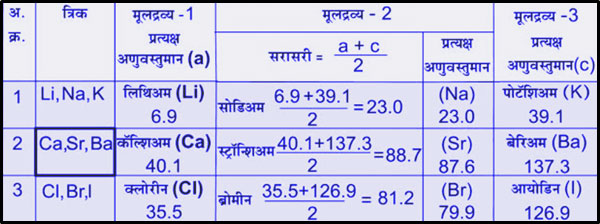
डोबेरायनरची त्रिके
तीन मूलद्रव्यांचा एक गट म्हणून त्याला त्रिके म्हटले आहे. मूलद्रव्यांची मांडणी त्यांच्या वस्तूमानानुसार केली असता असे लक्षात आले की पहिल्या व तिसऱ्या मूलद्रव्यांच्या वस्तुमानाची सरासरी म्हणजे दुसऱ्या मूलद्रव्याचे वस्तुमान. परंतु अशी आणखी त्रिके काही सापडली नाहीत. नंतर काय झाले असेल? अजून काही
वेगळ्या तर्हेने मूलद्रव्यांची मांडणी करता येईल का असा विचार सुरू झाला असेल. अर्थातच या वेळी सुद्धा अणूचे वस्तुमान हेच विचारात घेतले गेले असेल. अशा तर्हेची मांडणी करताना बऱ्याच अडचणी आल्या. त्यातील महत्त्वाची म्हणजे अणूचे वस्तुमान नेमकेपणाने मोजले जात नव्हते. काहीवेळा संयुगांनाच अणू समजले जात होते.

न्यूलँड
यातूनच मार्ग काढत शास्त्रज्ञांनी अणुवस्तुमानांच्या चढत्या क्रमाने मूलद्रव्ये मांडली. सारख्या रासायनिक गुणधर्मांची मुलद्रव्ये एकाखाली एक येतील अशी मांडणी करायचा प्रयत्न केला. त्यामुळे सारणी म्हणजेच कोष्टक तयार झाले. आतापर्यंत 56 मूलद्रव्ये माहिती झाली होती. न्यूलँड या शास्त्रज्ञाच्या 1863 साली असे लक्षात आले की प्रत्येक आठवा व त्याच्या पटीत येणाऱ्या मूलद्रव्यांचे गुणधर्म सारखे आहेत. यालाच आवर्तीफल असे म्हणण्यात आले. हाच न्यूलँडचा अष्टकाचा नियम. (त्यावेळेला माहित असलेल्या सात सुरांनंतर येणारा आठवा सूर पहिल्या सुरासारखाच असतो यावरुन हे नाव दिले.) यामध्ये अष्टक हा शब्द आठ आकडा दाखवत असला तरी प्रत्यक्ष सातच गट होतात हे लक्षात घ्यावे लागते (जसे सूर सातच असतात.)
आता एक सारख्या गुणधर्मांची मूलद्रव्ये एकत्र करण्यात आली व त्याला गट असे नाव मिळाले.
म्हणजे मूलद्रव्यांच्या सारणीला आवर्त हा शब्द जोडला गेला. आवर्त म्हणजे पुन्हा पुन्हा होणे. जशी पुस्तकांची आवृत्ती निघते किंवा एखाद्या जपाची आवर्तने केली जातात तसेच. या सारणीत, त्यावेळी माहित असलेली 56 मूलद्रव्ये सात गटांच्या आठ ओळी अशा तऱ्हेने मांडली आहेत. हा अष्टकाचा नियम कॅल्शियम या धातूपर्यंत चांगल्या प्रकारे लागू पडत होता. नंतर मात्र आठव्या मूलद्रव्याचे गुणधर्म आधीच्या मूलद्रव्याप्रमाणे दिसेनात.
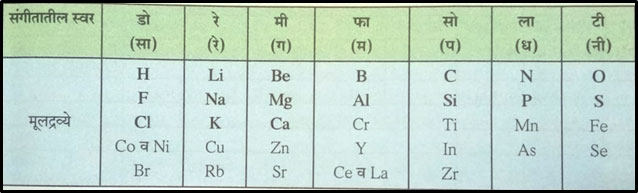
न्यूलँडची अष्टके
मेंडेलीव्हची आवर्तसारणी - एक मैलाचा दगड

आधी सांगितल्याप्रमाणे मूलद्रव्याचे वर्गीकरण करण्याचे व केलेले संशोधन शोधनिबंधाद्वारे प्रसिद्ध करण्याचे काम जगभर चालू होते. लोथर मेयर व दिमित्री मेंडेलीव्ह या दोन शास्त्रज्ञांचे असे प्रयत्न साधारण एकाच वेळी म्हणजे 1864 च्या सुमारास सुरू होते. 63 मूलद्रव्ये माहीत झाली होती. दोघांनी एकाच पद्धतीची मांडणी सुचविली परंतु दिमित्री मेंडेलीव्हची आवर्त सारणी लोथल मेयरच्या आधी एक वर्ष म्हणज 1869 मध्ये प्रसिद्ध झाली व या मांडणीचे श्रेय मेंडेलीव्हच्या नावावर जमा झाले. या आवर्तसारणीला नुकतीच 150 वर्षें पूर्ण झाली. म्हणून 2019 हे वर्ष आवर्तसारणीचे आंतरराष्ट्रीय वर्ष म्हणून साजरे केले गेले.
एवढे काय होते या मांडणीमध्ये की ज्यामुळे त्याला एवढे महत्त्व प्राप्त झाले. सगळ्यात महत्वाचे म्हणजे मेंडलीव्ह याने अतिशय शास्त्रशुद्ध पद्धतीने मूलद्रव्यांची माहिती जमा केली व त्यांच्या संयुगांचा अभ्यास केला. वेगवेगळ्या मूलद्रव्यांची, हायड्रोजन व ऑक्सिजन या मूलद्रव्यांबरोबर होणारी संयुगे तपासली. आता प्रश्न पडेल की हायड्रोजन व ऑक्सिजन हीच मूलद्रव्ये का विचारात घेतली? त्याला कारण असे होते की जवळ जवळ सर्व मूलद्रव्यांची संयुगे या दोन मूलद्रव्यांबरोबर उपलब्ध होती. संयुगांचे विघटन करून ठराविक वजनाच्या हायड्रोजन किंवा ऑक्सिजन बरोबर कोणते मूलद्रव्य किती प्रमाणात रासायनिक बंधाने जोडले आहेत त्याचा अभ्यास करता आला. त्यावरून रेणूसुत्रे तयार करता आली.
उदा. RH, R2H, R3H किंवा R2O, RO, R2O3. ह्या सूत्रांमधे R हे अक्षर मूलद्रव्यासाठी वापरले आहे. उदा. LiH, Li2O, CH4, CO2. या सुत्रांमुळे मूलद्रव्यांच्या वस्तुमानांचा अंदाज बांधता आला.
यानंतरची पुढची पायरी म्हणून प्रत्येक मूलद्रव्यासाठी एक कार्ड त्याने तयार केले. त्या कार्डावर प्रत्येक मूलद्रव्याचे नाव, संज्ञा, वस्तुमान, भौतिक गुणधर्म व रासायनिक गुणधर्म यांची नोंद केली. नंतर आपण पत्त्याच्या पेशन्स या खेळात ज्या तऱ्हेने पत्ते मांडतो त्या तऱ्हेने, आधी एक पत्ता नंतर दोन त्यानंतर तीन याप्रमाणे, मूलद्रव्यांच्या वस्तुमानांच्या चढत्या क्रमाने ही कार्डे मांडून घेतली. त्याच वेळी एक सारख्या गुणधर्मांची कार्डे एकाखाली एक मांडली. त्यामुळे या मांडणीत किंवा सारणीत डावीकडून उजवीकडे जाताना तसेच एका गणात वरून खाली जाताना अणुवस्तुमानांचा चढता क्रम आला. (हे म्हणजे तुम्ही शाळेत प्रार्थनेला उभे राहता तेव्हा इयत्तेप्रमाणे रांगा करता व प्रत्येक रांगेत उंचीने सर्वात कमी असलेला मुलगा सर्वात पुढे व त्यानंतर उंची नुसार मुले उभी राहतात तसेच काहीसे.) मेंडेलीव्ह याने एकाखाली एक येणाऱ्या मूलद्रव्यांना म्हणजेच एका गणातील मूलद्रव्यांना एक कुटुंब (family) मानले. उदा. अल्कली धातू, अल्कधर्मी मृदा धातू, हॅलोजन वगैरे. या मांडणीमुळे असे लक्षात आले की मूलद्रव्यांचे भौतिक व रासायनिक गुणधर्म त्यांच्या ‘वस्तुमानांचे आवर्ती फल’ असते. म्हणजेच मूलद्रव्यांचे गुणधर्म वस्तुमानाच्या ठराविक अंतरा नंतर सारखेच दिसतात. त्याने केलेली मांडणी कशी दिसत होती ते पुढील सारणीत बघा.
या आवर्तसारणीचे नीट निरीक्षण करा. या निरीक्षणातून काय लक्षात येते त्याची नोंद करूया.
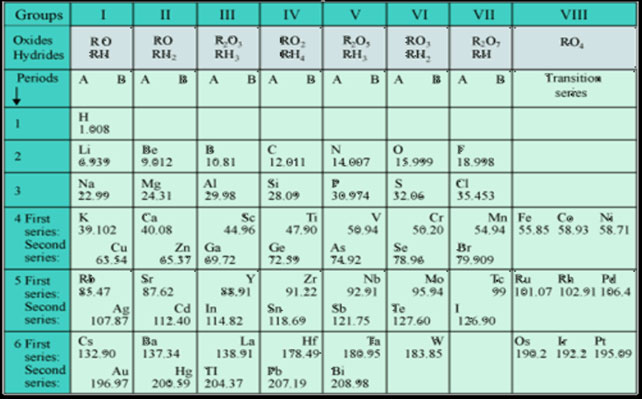
मेडेलीव्हची आवर्तसारणी
आवर्त सारणीची वैशिष्ट्ये
- मूलद्रव्यांची मांडणी भौतिक व रासायनिक गुणधर्म लक्षात घेऊन केली आहे. संयुगांचा विचार करताना एकसारखी रेणूसुत्रे प्रमाणित धरून ही मांडणी करण्यात आली आहे. सारणीच्या प्रत्येक गणात ही सूत्रे लिहिलेली दिसतात. एकूण 8 गण व 6 ओळी दिसत आहेत.
- सुरुवातीला काही ठिकाणी मोकळ्या जागा ठेवल्या होत्या त्या मुद्दामच संभाव्य मूलद्रव्यांसाठी सोडल्या होत्या. कारण वस्तुमानानुसार येणारे मूलद्रव्याचे गुणधर्म आधीच्या ओळीतील मूलद्रव्यांच्या बरोबर जुळत नव्हते. त्यामुळे या मूलद्रव्यांना थोडे पुढे सरकवून योग्य जागा दिली होती. जागेतील मूलद्रव्यांना एका बोरोन, एका ॲल्युमिनियम व एका सिलिकॉन अशी नावे दिली. (एका म्हणजे एक ओळ खाली). याच वेळी हेही नमूद करून ठेवले आहे की या ठिकाणची मूलद्रव्ये शोधली जातील व त्याने हे सुद्धा सांगितले की त्यांचे गुणधर्म काय असतील. कालांतराने या मूलद्रव्यांचा शोध लागला व त्यांना त्यांच्या योग्य जागेवर ठेवले गेले. ही मूलद्रव्ये म्हणजे अनुक्रमे स्कॅंडियम्, गॅलियम व जर्मेनियम.
- 9 मूलद्रव्यांचा आठवा गट 4, 5 व 6 व्या ओळीत दिसतो. त्यांना वेगळे ठेवण्याचे कारण म्हणजे त्यांचे गुणधर्म थोडे वैशिष्ट्यपूर्ण आहेत.
- तिसऱ्या ओळीपासून प्रत्येक चौकटीत दोन मूलद्रव्ये लिहिलेली दिसतात, जसे K /Cu , Ca /Zn. त्यांना A व B उपगट असे म्हटले आहे. या मूलद्रव्यांच्या संयुजा लक्षात घेऊन हे स्थान दिले आहे. कमी वस्तुमानाचे मूलद्रव्य A उपगटात तर जास्त वस्तुमानाचे मूलद्रव्य B उपगटात लिहिली आहेत.
- मांडणीत राजवायू देखील दिसत नाहीत. ज्यावेळी ही मांडणी तयार झाली त्यावेळी त्यांचा शोध लागला नव्हता. लवकरच तो शोध लागला. यांच्या गुणधर्मातील साधर्म्यामुळे त्यांचा वेगळा गण केला गेला. आवर्तसारणीला धक्का न लावता त्याला स्वतंत्र जागा दिली गेली. राजवायू इतर मूलद्रव्यां बरोबर संयुगे करीत नाहीत. त्यांची संयुजा ‘०’ असते. त्यामुळे या गणाला ‘शून्य गण’ म्हटले गेले.
अशी बरीच वैशिष्ट्ये असली तरी या सारणीत सुद्धा काही त्रुटी होत्या.
- हायड्रोजनची जागा तो अधातू असल्यामुळे हॅलोजन गटाच्या वर असावी की त्याची +1 संयुजा लक्षात घेऊन अल्कली धातूंच्या गणात ठेवावे हे स्पष्ट होत नव्हते.
- मांडणी जरी वस्तुमानाच्या चढत्या क्रमाने केली असली तरी काही वेळा कमी वस्तुमानाचे मूलद्रव्य जास्त वस्तुमानाच्या मूलद्रव्याआधी आलेले दिसते उदा. कोबाल्टचे वस्तुमान निकेलच्या वस्तुमानपेक्षा कमी आहे तरी देखील कोबाल्टची जागा निकेलच्या आधी आहे. हे स्थान या दोन्ही मूलद्रव्यांचे रासायनिक गुणधर्म लक्षात घेऊन ठरवले आहे.
असे असले तरी या सारणीचा उपयोग बऱ्याच मूलद्रव्यांच्या अभ्यासासाठी होऊ शकला. मूलद्रव्याच्या स्थानावरून त्याचे गुणधर्म काय असतील याचा अंदाज बांधता येऊ शकला.
तरी देखील या सारणीत काही त्रुटी आहेत व यात काही बदल होणे आवश्यक आहे असे ॲन्टोन व्हेन डॅन ब्रुक यासारख्या शास्त्रज्ञांनी सुचवले होते. तसा बदल लवकरच करावा लागला. कारण ठरले वैज्ञानिक प्रगती.
विसाव्या शतकाच्या सुरुवातीला अणूच्या अंतरंगाबद्दल बरीच माहिती शास्त्रज्ञांना झाली. मूलद्रव्यांच्या गुणधर्मातील बदल हे वस्तुमानाऐवजी अणुअंकावर अवलंबून असतात हे लक्षात आले.
एकोणीसाव्या शतकाच्या शेवटी व विसाव्या शतकाच्या सुरुवातीला विज्ञानाची प्रगती फारच झपाट्याने झाली. अनेक शोध एकापाठोपाठ एक लागले. त्यात एक्सरे (1895), इलेक्ट्रॉन(1897), प्रवाही विद्युत (1895), किरणोत्सर्गी पदार्थ व त्यातून उत्सर्जित होणारे किरण(1895) हे शोध महत्वाचे ठरले. त्यामुळे अणू हा द्रव्याचा लहान कण असला तरी तो अविभाज्य आहे ही कल्पना बदलावी लागली. या शोधांमधील माहितीच्या आधारे रुदरफोर्ड याने 1911 मध्ये व नील्स बोहर याने 1913 मध्ये अणूचे नवीन प्रारूप जगापुढे ठेवले. त्यामुळे आता अणूमध्ये प्रोटॉन, न्यूट्रॉन व इलेक्ट्रॉन हे सूक्ष्म कण असतात हे लक्षात आले.
सन 1913 मध्ये हेनरी मोसेले यांनी मूलद्रव्यांच्या भौतिक व रासायनिक गुणधर्मांचा अभ्यास केला. तेव्हा त्यांच्या असे लक्षात आले की हे गुणधर्म मूलद्रव्यांच्या अणुअंकावर अवलंबून आहेत. तसेच त्यांच्या हेही लक्षात आले एक्सरे तयार होताना वापरण्यात येणारे धातू व बाहेर पडणाऱ्या एक्सरेची फ्रिक्वेन्सी धातू मधील अणुकेंद्रकातील धनप्रभारावर म्हणजेच केंद्रकातील प्रोटॉनच्या संख्येवर अवलंबून असतात शिवाय ठराविक अंतराने त्यांच्यात पुनरावृत्ती दिसून येते. या निरीक्षणावरून असे लक्षात आले की मूलद्रव्यांची मांडणी सुद्धा अणुअंकानुसार केली पाहिजे.
मूलद्रव्यांचे गुणधर्म अणुअंकावर अवलंबून आहेत हे लक्षात घेवून आवर्ती फलाचा नियम मांडला गेला. या नव्या नियमानुसार मूलद्रव्याचे भौतिक व रासायनिक गुणधर्म त्याच्या अणुअंकाचे आवर्ती फल असतात. मूलद्रव्याचे रासयनिक गुणधर्म अणूमधील इलेक्ट्रॉन संरुपणावर आधारित असतात. त्यामुळे आपल्याला अणूच्या अंतरंगाबद्दल व संरुपणाबद्दल माहिती असायला हवी. याची माहिती अणू संरचना या लेखात सविस्तर दिली आहेच. त्यातील महत्वाचे मुद्दे पुढे दिले आहेत ते नीट समजावून घ्या.
अणू संरचना (उजळणी)
- अणुअंक (z) = केंद्रकातील प्रोटॉनची संख्या = इलेक्ट्रॉनची संख्या.
- अणुवस्तुमानांक (A) = केंद्रकातील प्रोटॉनची संख्या + केंद्रकातील न्यूट्रॉनची संख्या.
- X हे मूलद्रव्य लिहिण्याची पद्धत X z A उदा. Na 1123
इलेक्ट्रॉन संरुपण
केंद्रका जवळील कक्षा/कक्षिके मधील इलेक्ट्रॉनची ऊर्जा कमी. जसजसा इलेक्ट्रॉन केंद्रकापासून दूर जाईल तशी त्याची ऊर्जा वाढत जाते. इलेक्ट्रॉनची उर्जा जसजशी वाढेल तसतसा तो बाहेरील कक्षेत जातो. कमी ऊर्जेचा स्तर आधी भरला जातो त्यानंतर क्रमाने पुढील ऊर्जा स्तर भरले जातात. मुख्या ऊर्जा स्तर, उप उर्जा स्तर व त्यानुसार इलेक्ट्रॉन सामावून घेण्याची क्षमता पुढील तक्त्यात दिली आहे.
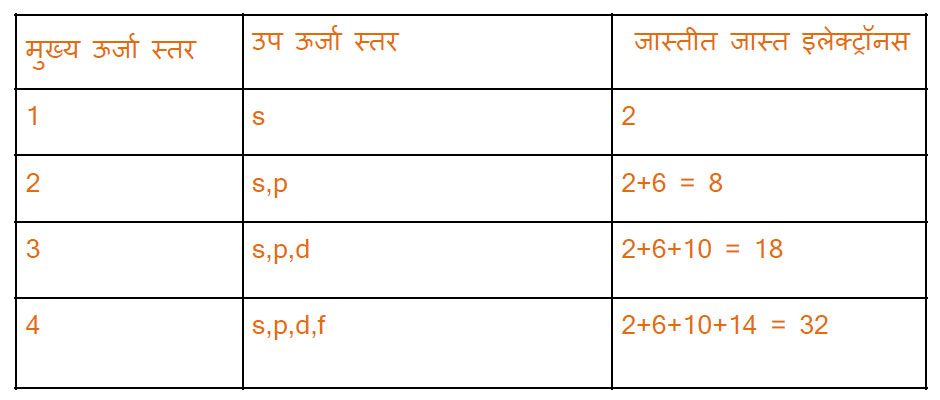
उर्जेनुसार उर्जा स्तरांचा क्रम
(1s), (2s,2p), (3s,3p), (4s,3d,4p), (5s,4d,5p), (6s,4f,5d,6p), (7s,5f,6d,7p).
मूलद्रव्यांचे इलेक्ट्रॉन संरुपण
आधी दिलेल्या माहितीच्या आधारे आता काही मूलद्रव्यांचे संरूपण लिहूया.
पहिले मूलद्रव्य H 1 z =1, e = 1 बरोबर ना?
हा इलेक्ट्रॉन सर्वात कमी उर्जेच्या म्हणजे कोणत्या ऊर्जा स्तरात प्रवेश करेल? 1s मध्ये नाही का? त्यानुसार हायड्रोजनचे (H) इलेक्ट्रॉन संरुपण 1s1.
पुढील मूलद्रव्य He 2, z = 2, e = 2.
दुसरा इलेक्ट्रॉन कोणत्या ऊर्जास्तरात लिहीता येईल? पहिला ऊर्जास्तर म्हणजे 1s मध्ये अजून एक इलेक्ट्रॉन सामावू शकतो म्हणून हेलियमचे (He) इलेक्ट्रॉन संरुपण 1s2.
तुमच्या लक्षात आले का ? पहिला ऊर्जास्तर पूर्ण भरला गेला आहे.
यापुढील मूलद्रव्य Li3, z=3, e=3. पहिला ऊर्जास्तर पूर्ण झाल्यामुळे तिसरा इलेक्ट्रॉन पुढील ऊर्जास्तरात म्हणजे 2s मध्ये प्रवेश करेल. त्यामुळे लिथियमचे (Li) इलेक्ट्रॉन संरुपण 1s2, 2s1 असे होईल. हायड्रोजन प्रमाणेच या मूलद्रव्यातसुद्धा शेवटचा एक इलेक्ट्रॉन s या उपकक्षेत आहे. याच क्रमाने पुढील मूलद्रव्यांची म्हणजे Be4, B5, c6, N7, O8, F9 व Ne10 या मूलद्रव्यांचे इलेक्ट्रॉन संरुपण लिहीता येईल ना? लक्षात घ्या की बोरॉन पासून इलेक्ट्रॉन 2p या उर्जास्तरात असेल व क्रमाने पुढील पाच इलेक्ट्रॉन 2p मध्येच भरले जातील. Ne 10 या मूलद्रव्याचे इलेक्ट्रॉन संरुपण 1s2, 2s2, 2p6 या ठिकाणी दुसरा ऊर्जास्तर पूर्ण होईल.
यानंतरची आठ मूलद्रव्ये म्हणजे Na11 ते Ar18 मध्ये 3s, 3p हे ऊर्जा स्तर भरले जातील. आर्गॉनमधे तिसऱ्या कक्षेत आठ इलेक्ट्रॉन्स असतील.
तरीदेखील तिसऱ्या कक्षेतील 3d हा ऊर्जास्तर अजून भरलेला नाही. आता ऊर्जा स्तरांचा क्रम लक्षात घ्या. 3d या ऊर्जास्तराआधी 4s हा ऊर्जा स्तर येतो. म्हणजेच 4s ची ऊर्जा 3d पेक्षा कमी आहे.त्यामुळे K 19 या मूलद्रव्यात इलेक्ट्रॉन 4s या ऊर्जास्तरात भरला जाईल. त्यामुळे या मूलद्रव्याबरोबर चौथी कक्षा भरायला सुरुवात होईल. Ca20 या मूलद्रव्याचे इलेक्ट्रॉन संरूपण 1s2,2s2,2p6,3s2,3p6,4s2 असे असेल. त्यानंतर Sc21 ते Zn30 या मूलद्रव्यांच्या अणुंमध्ये, 3d ऊर्जास्तरात, क्रमाने 10 इलेक्ट्रॉन्स भरले जातील व नंतर क्रमाने 5p हा ऊर्जा स्तर भरेल.
अशा तऱ्हेने ऊर्जास्तरांचा क्रम लक्षात घेऊन माहित असलेल्या सर्व 118 मूलद्रव्यांचे इलेक्ट्रॉन संरूपण लिहिता येईल.
आता या माहितीच्या आधारे मूलद्रव्यांचा अणुअंक, इलेक्ट्रॉन संरुपण, भौतिक व रासायनिक गुणधर्म लक्षात घेऊन मूलद्रव्यांची मांडणी करता येईल. ही मांडणी करताना मूलद्रव्ये अणुअंकानुसार मांडून एक सारखे बाह्य इलेक्ट्रॉन संरूपण असणारी मूलद्रव्ये एका खाली एक येतील अशी मांडणी करावी लागेल. (बाह्य इलेक्ट्रॉन संरुपणावर मूलद्रव्याचे रासायनिक गुणधर्म अवलंबून असतात.)
तसेच नवीन कक्षा सुरू झाली की नवीन ओळ सुरू होईल. हे सर्व लक्षात घेऊन मांडणी केली असता ती पुढील प्रमाणे दिसेल. हीच मूलद्रव्यांची आधुनिक आवर्तसारणी.
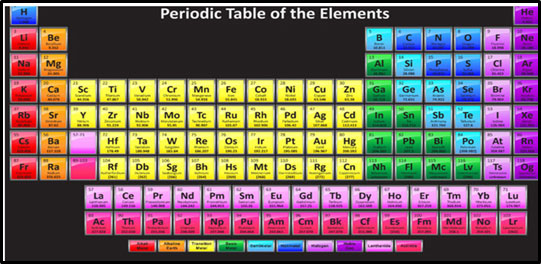
या आवर्तसारणी बद्दल आपण बरीच माहिती मिळवणार आहोत. पण ते पुढील भागात.
Send us your feedback
All diagrams, pictures, tables etc. are from websites on Internet. We are thankful to all these sources.
Vidnyanvahini is a Non-Governmental Organisation (NGO) and this entire write up is for students, teachers and general public, free of charge.
IT IS NOT FOR ANY COMMERCIAL USE.
