रसायन शास्त्र (Chemistry) 
9 September 2020
द्रव्याचे स्वरूप (भाग 1)
28 October 2020
द्रव्याचे स्वरूप (भाग 2)
4 November 2020
अणू संरचना (भाग - 1)
25 December 2020
अणू संरचना (भाग - 2)
8 January 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 1)
28 April 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 2)
13 May 2021
धातू व अधातू
5 September 2021
धातू व अधातूचे रासायनिक गुणधर्म
19 September 2021
आमची खात्री आहे की तुम्ही ‘अणुसंरचना - भाग -१’ नक्कीच वाचला असेल.
इ.स. पूर्वी ५०० वर्षांपासून ते अगदी इ.स. १९१३, म्हणजे बोरने सांगितलेल्या अणूच्या या रचनेपर्यंत (Atomic Structure), काही शास्त्रज्ञानीं केवळ तर्क करून (Logical Thinking) परंतु नंतर अनेकांनी प्रयोगात्मक अभ्यास करून (Experimental Study) अणूंच्या वेगवेगळ्या प्रतिकृती मांडल्या. महत्वाचे म्हणजे आपण वैज्ञानिक दृष्टिकोन ठेऊन म्हणजेच, ‘ तर्क, कारणमीमांसा व प्रायोगिक पुरावा (Logic, reasoning and experimental proof) याचा आधार घेऊन निर्णयाप्रत येणे ’ ही पद्धत अंगिकारून त्याचा मागोवा घेतला. आता आपला नवीन भाग सुरु करताना आपल्या नाटकातील बोर (बोहर ) च्या रंगमंचावरील प्रवेशानंतरचा थोडा भाग, सिनेमातल्यासारखा ‘ फ्लॅश बॅक ’ पाहणं उचित ठरेल. जसं टी. व्ही. वरील सीरियलमध्ये प्रत्येक नवीन भाग सुरु करताना ‘ Recap ’ दाखवतात ना, तसंच. म्हणजे संदर्भ लागायला सोपं जातं.
फ्लॅश बॅक (Flash Back)
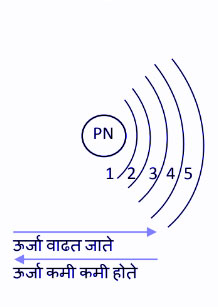
अणूचं चित्र असं झालं. अणूमध्ये जास्त घनता असलेलं केंद्रक/गाभा/Nucleus असतं. त्यांत धनभारित प्रोटॉनस् व भाररहित न्यूट्रॉनस् (Neutrons) असतात आणि केंद्रकाभोवती ऋणभारित इलेक्ट्रॉनस्, वेगवेगळ्या कक्षातून फिरत असतात. त्यांची संख्या प्रोटॉनच्या संख्येइतकीच असते. त्यामुळे सबंध अणू प्रभाररहित असतो. प्रोटॉनच्या संख्येवरून तो पदार्थ ठरतो. उदाहरणार्थ हायड्रोजनच्या अणूमध्ये एक प्रोटॉन, हिलियममध्ये दोन प्रोटॉनस् किंवा उलट म्हणूया तीन प्रोटॉनस् म्हणजे लिथियम चा अणू, चार म्हणजे बेरिलियम इत्यादी. एक एक प्रोटॉन वाढवत गेलं तर आपल्याला धातू, अधातू असे वेगवेगळे पदार्थ मिळतात. प्रत्येक अणूतील इलेक्ट्रॉनस्, वेगवेगळ्या कक्षांतून / orbits किंवा अधिवास / orbitals यांतून फिरत असतात. त्यांना 'उर्जा कक्षा / Energy Levals असं म्हणतात. केंद्रकाच्या जवळच्या कक्षेची उर्जा सर्वात कमी आणि ती तिच्या पुढच्या पुढच्या कक्षेतून वाढत जाते आणि वरून खाली येताना कमी कमी होत जाते. अणू हा sphere सारखा असतो, म्हणजेच त्रिमितीत असतो हे लक्षात ठेवायचं.
मॅक्स प्लॅंक

घरात आईनं एखादा नवीन पदार्थ केला की आई सांगते ना 'अरे खाऊन तर पहा. तुला खाऊन पाहिल्याशिवाय कसं कळेत तो कसा आहे.' हो की नाही? अगदी तशीच एक छोटीशी गोष्ट आम्ही सांगणार आहोत. त्याचं नांव ऐकून 'छे हो, आपल्याला कसे कळणार असं म्हणू नका हं.' तुम्हाला कळणार आहे. तर १९ व्या शतकाच्या शेवटी मॅक्स प्लॅंक यांनी एक नवीनच कल्पना मांडली. त्याचं नाव आहे 'पुंज भौतिकशास्त्र' (Quantum Mechanics). त्या मॅक्स प्लॅंक या जर्मन शास्त्रज्ञाला 'क्वांटम मेकॅनिक्सचा जनक' म्हणतात. त्यानं काय सांगितलं की कोणत्याही पदार्थातील (आपण अणूसंबंधी बोलतोय) उर्जेची पातळी ही बागेतील घसरगुंडीसारखी सलग कमी/जास्त होत नाही. तर टप्प्याटप्प्याने पायऱ्या पायऱ्याने बदलते. म्हणजे काय, तर दोन लागोपाठच्या पायऱ्यांमध्ये आणखी उर्जेची पातळी असूच शकत नाही, समजलं का? मला माहित आहे की समजलं परंतु अजून नीट नाही कळलं हो ना? प्लँक यांना असं म्हणायचंय इलेक्ट्रॉन्स एका कक्षेतून दुसर्या कक्षेत जाताना घसरगुंडीसारखे हळूहळू पातळीत फरक पडत नाही तर पायऱ्यांसारखे एकदम या पायरीवरून पुढच्या किंवा मागच्या पायरीवर उडी. तुम्ही नाही का जिना चढताना - उतरताना धडाधड उड्या मारीत एक एक किंवा अधिक पायरी गाठता तसंच! नाही समजलं ? OK Let's see समजा , दुचाकी वाहन ४-६ फूट उंचीवर न्यायचे असेल किंवा खाली आणायचे तर ते पायऱ्यांवरून नेतात कीं पायऱ्यांच्या बाजूला उतरता भाग (slope/ramp) केलेला असतो त्यावरून ? त्या उतरत्या भागावरून, पायऱ्यांवरून नाहीं. त्याच्या विरुद्ध इलेक्ट्रॉन्स मात्र पायऱ्या पायऱ्याने उड्या मारतात. इलेक्ट्रॉन्सची उर्जा कमी झाली की आलाच खालच्या पायरीवर समजलं ? म्हणून यापुढे कधीही नुसता विषय/ टॉपिकचे नाव ऐकून उगाचच म्हणायचे नाही की नाही रे, ते काय कळणार नाही आपल्याला, ठेवाल ना लक्षात? आता मात्र नाटकातील कलाकार कोण? तुम्ही आणि आम्ही. आपणच एकमेकांशी गप्पा मारायच्या. ठीक आहे?
इलेक्ट्रॉन्सच्या कक्षा /orbits, उपकक्षा /orbitals
बोर, रुदरफोर्ड यांनी मॅक्स प्लॅंक यांनी मांडलेल्या कल्पनांचा , त्यांच्या Theory चा, चांगला उपयोग करून घेतला.तसेच सॉमरफिल्ड यांनी नुसत्या १,२,३,४ ---- अशा कक्षांबरोबरच s,p,d,f अशाही उपकक्षा असतात ही कल्पना सुचविली आणि पटवून दिली. आपण पुढील आकृती पहायची का ? चला नुसतं बघायचं नाही बरं का ?' निरीक्षण' करायचं कारण त्यावर आपण चर्चा करणार आहोत ना ठीक, Ok?
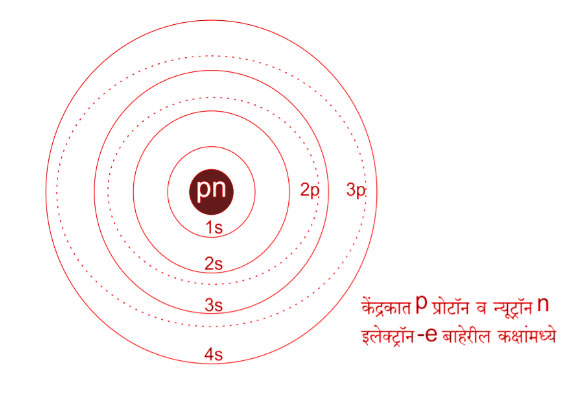
मग सांगा पाहू काय पाहिले आकृती मध्ये? गोल गोल रेषा ? अरे असं नाही, आपण अणूसंबंधी बोलतोय ना? हां, Yes, अणूच्या या आकृतीत मध्यभागी केंद्रक दिसतंय. पुढे त्यात p व n आहेत. छान आणि केंद्रकाभोवती इलेक्ट्रॉन्स -e, फिरत आहेत. That's good. सगळ्या कक्षा कशा आहेत? गोल? नीट पहा बरं. सांगा, काही वर्तुळाकार तर काही लंबवर्तुळाकार, अरे त्याहूनही एक अतिलंबवर्तुळाकार आणि सर, दीर्घलंबवर्तुळाकारही असणार आहे . Excellent ! आणखी काय निरीक्षण केलंत? सर त्या कक्षांना नावे दिली आहेत 1s, 2s, 2p, 3s, 3p, 4s वगैरे. बरोबर. पण त्यांचा क्रम पहा बरं. सांगा. केंद्रकाच्या जवळची 1s, नंतर 2s वगैरे शाबास. मग 1s कक्षेचा आकार कसा आहे ? वर्तुळाकार. अशी आणखी कोणती आहे का? अं, अं हो सर 1s नंतर 2s नंतर 3s नंतर 4s अगदी बरोबर. मग आपण नक्कीच म्हणू शकू की 's' म्हटलं की ती कक्षा वर्तुळाकारच असणार. शाबास. आता p म्हटलं की लंबवर्तुळाकार, तुम्ही विचार करा की पुढची कशी असेल ? दीर्घवर्तुळाकार.त्याच्यापुढे अतिदीर्घ बरोबर ना ? पण सर
s, p, d, f हे कशाचे short form आहेत आणि त्यांची मांडणी कशी आहे ?
तर पहा s = Sharp; p = Primary, d = Diffused, f = Fundamental.
इलेक्ट्रॉनला अधिक उर्जा मिळाली की तो बाहेर- बाहेरच्या कक्षेत आलाच. ते आतल्या कक्षेत कसे येऊ शकतील? तर त्यांची उर्जा कमी झाली तर म्हणजे काही उर्जा बाहेर टाकावी लागणार ? ठीक आहे ? ती फोटॉनच्या / प्रकाशाच्या स्वरुपात बाहेर पडते. किती उर्जा बाहेर पडते त्यावर त्याचा रंग अवलंबून असातो. त्यावेळी जो वर्णपट (spectrum ) तयार होतो त्यांच्या निरीक्षणावरून s, p, d,f नांवे दिलेली आहेत.
इलेक्ट्रॉन संरूपण
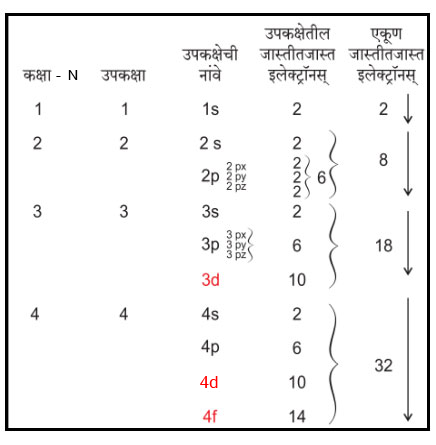
मुलांनो, चार्ट पाहिलात का? पाहिलात की निरीक्षण केलंत? नीट पहा बरे. ज्या क्रमांकांची कक्षा, तेवढ्या त्यांत उपकक्षा. Good. म्हणजे कक्षा क्र. -१, उपकक्षा -१, कक्षा क्र. -2 तर उपकक्षा -2 म्हणून आपण असं म्हणूं शकतो की N = 1 असेल तर उपकक्षा 1, N = 4 असेल तर उपकक्षा? पुढे सांगा : s उपकक्षा असेल तर इलेक्ट्रॉनस् 2 च. 1s = 2, 2s = 2, 3s = 2 That's good. 2p = 6….. बरोबर प्रश्न विचारलात की 2px, 2py, 2pz हा काय प्रकार आहे? त्यांच असं आहे, त्रिमितीमध्ये तीन अक्ष, x, y, z एकमेकांशी 900 कोनात असतात. प्रत्येकात दोन इलेक्ट्रॉनस. म्हणून p मध्ये 6 . आपण आपल्या अभ्यासात p = 6 असंच आता धरु या. बरं. आता मगाचाच चार्ट पहा बरं. काही गडबड दिसते का? नाही? बरं ! 1s कक्षा आहे ? 2s, 2p आहेत. पुढे बघा. अगदी बरोबर 3s, 3p आहेत पण नंतर 3d आणि 4f ही वेगळ्या रंगात का लिहिली आहेत बरं? त्याचं कारण असं आहे की आपण या कक्षांचे काय वैशिष्ट्य पाहिले आहे?अरे त्यांना उर्जा पातळी म्हटलं आहे ना ? मग केंद्रकाजवळच्या 1s उपकक्षेची ऊर्जा किती असते ? सर्वात कमी आणि नंतर 2s त्याहून जास्त, 2p त्याहून जास्त. असं प्रयोगांनी सिद्ध झालं आहे. 3d ची ऊर्जा 4s पेक्षा जास्त म्हणून ती 4s नंतर भरणार ना ?
तसेच 4d>5s. मग त्यांचा ऊर्जाक्रम आपण पाहू या. पुन्हा निरीक्षण करा. (1s),(2s,2p), (3s,3p), (4s,3d,4p), (5s,4d,5p), (6s,5d,4f,6p), (7s,6d,5f,7p) हे असं का लिहिलं ते समजावून घेऊं.
बरं? तुम्ही शाळेत प्रथम कुठल्या इयत्तेत प्रवेश घेतां? सोपं आहे? त्या नंतर एकेक पायरी वर वर चढता. तसेच प्रयोगान्ती ठरविले कीं उर्जाक्रमांकानुसार इलेक्ट्रॉनच्या इयत्ता आहेत आणि इलेक्ट्रॉन नेहमी पहिल्या कक्षेत जाण्याचा प्रयत्न करतो. अर्थात त्या कक्षेत जागा असेल तर. गंमत पहा की प्रत्येक कक्षेत (इलेक्ट्रॉनच्या इयत्तेत) एक - एकच बाक आहे. म्हणून 1s मध्ये एक बाक, प्रत्येक बाकावर फक्त दोन इलेक्टॉनस् बसू शकतात. तो बाक भरला, म्हणजे 1s मध्ये दोन इलेक्टॉनस् भरले, की त्यानंतरची कमीत कमी उर्जेची कक्षा कोणती? तुम्ही सांगा 2s. बरोबर ना? मग ती भरायला सुरुवात. त्यांत 2 इलेक्ट्रॉनस झाले की ती उपकक्षा भरली, तसेच पुढे पुढे. समजले?
‘ऑफबो’ चे तत्व
जर्मन भाषेत ऑफबो म्हणजे Building up म्हणून building up principle असे नांव पडले. म्हणजे काय तर इमारत बांधणीचे तत्व किंवा पद्धत. इमारत बांधताना प्रथम तळमजला, त्यांत समजा दोनच खोल्या, नंतर पहिला (वरचा) मजला असे वरचे वरचे मजले.या तत्वाप्रमाणे इलेक्ट्रॉन हे प्रथम खालच्या मजल्यावर, तळ मजल्यावर (त्याला पहिला मजला म्हणू) थांबण्याचा प्रयत्न करतात. तेथे दोनच खोल्या आहेत. दोनच इलेक्ट्रॉनस् (जास्तीत जास्त) राहतात. त्यानंतर येणाऱ्या इलेक्ट्रॉनला जागा नाही, मग ते काय करतील? वरच्या दुसऱ्या मजल्यावर म्हणजे एक नंतरचा येणारा जास्त उर्जेचा मजला आणि पुढचे तुम्हीच सांगा बरं. आपण इयत्तेचे उदाहरण पाहिले ते आठवा. म्हणजे तुम्हाला ऑफबोचे तत्व समजले OK?
यानंतर orbits आणि orbitals म्हणजे काय ते नाहीं समजलं सर. खरंच कीं आपण खालील तक्ता पाहूं . तो वाचलात की तुम्हाला कक्षा (orbits ) व अधिवास ( orbitals ) यातील फरक लगेचच कळेल.
|
Orbits/कक्षा |
Orbitals/अधिवास |
|
न्यूक्लिअसच्या भोवती इलेक्ट्रॉन फिरतात त्याचा दाखवलेला वर्तुळाकार मार्ग. |
न्यूक्लिअसभोवती ठराविक भाग असतो की ज्यात इलेक्ट्रॉन असण्याची शक्यता. |
|
ते द्विमितीत दाखविलेले असते. |
ती त्रिमितीत दाखविले जाते. |
|
ते जो मार्ग दाखवितात (त्यात अनिश्चिततेचा सिद्धांत धरलेला नाहीं. हे नंतर पुढल्या इयत्तेत समजेल. आता, विसरून जा.) |
ठराविकच मार्ग न दर्शवता त्यांत दाखविलेल्या भागात कोठेही इलेक्ट्रॉन असण्याची शक्यता असते. |
|
सर्व कक्षा वर्तुळाकार (लंबवर्तुळाकार वगैरे) असतात. |
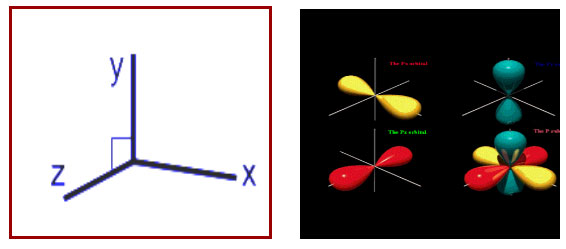
त्यांचे आकार वेगवेगळे असतात. वर्तुळाकार किंवा डंबेल्ससारखे इत्यादी. |
|
त्यांना दिशेचे गुणधर्म नसतात.कोणत्याही दिशेत असू शकतात. |
फक्त s लाच दिशेचा गुणधर्म असतो. |
|
इलेक्ट्रॉनस् ची विभागणी 2 n2 याप्रमाणे असते. n = कक्षा क्रमांक 1.मग 2 x 12= 2 इलेक्ट्रॉनस्. वगैरे. |
दोनपेक्षा जास्त इलेक्ट्रॉनस् एका अधिवासात राहू शकत नाहीत. |
मला माहित आहे. दिशेबद्दल तुम्हाला समजले नसणार, हो ना? आपण त्रिमितीचा विचार करतो तेव्हां XYZ अशा दिशा धरतो. म्हणून इलेक्ट्रॉनस् कोणत्याही दिशेत फिरत असू शकतात. तर orbitales (अधिवास) यांतील s मध्यें ठराविक दिशेतच फिरतात. असो त्याच्या जास्त खोलात जाऊन आतां विचार करायला नको. आता आपण खालील आकृत्या पाहू की ज्यात तुम्हांला अधिवास, कक्षा वगैरे जास्त समजेल.
अहो सर, एवढं सगळं सांगितलंत परंतु आम्हांला एवढया 118 मूलद्रव्यांच्या संज्ञा, त्यांची इतर वैशिष्ट्ये कशी लिहायची ते नाहीं सांगितलंत.
मूलद्रव्यांच्या संज्ञा, अणुअंक इत्यादी
अणू कसा शोधला गेला, त्यात कोणते कोणते कण असतात, त्यांच्यावरचा प्रभार इत्यादी बरीच माहिती आपण घेतली. परंतु मूलद्रव्यांच्या संज्ञा, त्यात कणांची संख्या वगैरे थोडक्यात मांडायचे कसे ते आपण पाहूं तेच तुम्ही विचारत होतात ना, मुलांनो?
मूलद्रव्यांची नांवे वेगवेगळी (Different) असतात. ती कशी पडली, कोणी शोध लावला वगैरे गंमतीदार माहिती तुम्हाला आमच्या ह्याच उपक्रमातील सामान्यविज्ञान ह्या भागात वाचायला मिळेल ती जरूर वाचा. आतां तुम्हांला बरीच मूलद्रव्ये माहित आहेत असे धरून चालतो. Na हे सोडियम; Al अल्युमिनियम, Cu कॉपर, Xe झेनॉन वगैरे या सर्व मूलद्रव्यांच्या संज्ञाना X असे समजू, ठिक आहे? प्रत्येक मूलद्रव्यात प्रोटॉन (p) असतोच, न्यूट्रॉन (n) असतोच (फक्त हायड्रोजन सोडून), इलेक्ट्रॉन e असतोच.
आता समजा मी याचे थोडक्यात (short) मध्ये वर्णन असं केले, कसे?
.jpg)
मग काय वैशिष्ट्य दिसलं पहा बरं !
• तीनही अणूंना H हिच संज्ञा वापरली आहे. म्हणजे तीनही हायड्रोजन आहेत.
• तीनही अणूंचा अणूअंक समान आहे. (येथे 1 आहे.)
• मग फरक काय? प्रत्येकात न्यूट्रॉनची संख्या वेगळी आहे.
पहिल्यात न्यूट्रॉन नाहीच, दुसऱ्यात 1 न्यूट्रॉन तर तिसऱ्यात 2 न्यूट्रॉनस, बरोबर?
असे अणू असतील तर त्यांना एकमेकांचे ‘समस्थानिक’ (Isotope) असे म्हणतात. विचारा ना कीं यात समस्थानाचा प्रश्न कुठे आला? कोणतं स्थान तेच आहे? तुम्ही मगाशी ११८ मूलद्रव्ये (सध्या) म्हणालात. सगळी एकसारखी असतील का? नाहीं.
प्रत्येकाच्या गुणधर्मात काहीतरी फरक असला पाहिजे. तेव्हां त्यांचं वर्गीकरण करायचं झालं तर आतां ‘आधुनिक आवर्तसारिणी’ बनविलेली आहे. त्यांत प्रत्येक मूलद्रव्याच्या ‘अणूअंकानुसार’ मांडणी केली आहे. तेव्हां आत्तापर्यंत माहित असलेल्या एकूण एक मूलद्रव्यांची वाढत जाणाऱ्या अणुअंकानुसार मांडणी केली आहे. म्हणजे त्यात प्रत्येक मूलद्रव्याला ठराविक ठिकाणी म्हणजेच स्थानी लिहिले आहे. स्थान कशावरून ठरविले आहे? सांगा..... अरे, अणुअंकानुसार.
वरच्या तीनही H चा अणुअंक किती आहे? -- समान आहे, म्हणजे १. ‘अणुअंक तोच पण अणुवस्तुमानांक वेगळा’ असेल तर त्या मूलद्रव्यांना एकमेकांची ‘समस्थानके’ म्हणतात. या तीन प्रकारच्या हायड्रोजनच्याच अणूंना अनुक्रमे हायड्रोजन, ड्युटेरियम व ट्रिटियम म्हणतात.
अशी अनेक मूलद्रव्ये आहेत परंतु वेगवेगळी नांवे फक्त हायड्रोजनलाच दिली आहेत.
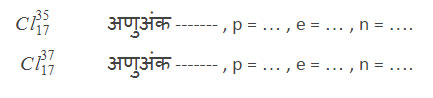
गाळलेले अंक भरा आणि सांगा ही एकमेकांची समस्थानके आहेत कीं नाहीत? त्यांची नांवे काय असतील? विशिष्ट्य नांवे फक्त हायड्रोजनलाच. याला क्लोरिन 35, क्लोरिन 37 म्हणतात.

समभारिके (Isobars) : अणुअंक वेगळा परंतु अणुवस्तुमानांक तोच.
समस्थानके (Isotopes) : अणुअंक तोच परंतु अणुवस्तुमानांक वेगळा.

जेथे तेथे अणूच!
आतां आपल्या भोवतालच्या सृष्टीतील स्थायू, द्रव व वायू असे विविध प्रकार कसे बनलेले असतील याची कल्पना तुम्हांला आली असेलच.रोज सकाळी उठल्यावर अनेकांना चहा लागतोच. त्यात अर्थातच साखर वापरली जाते. किती छान, पांढरे शुभ्र असतात ना साखरेचे कण; एकमेकांपासून वेगळे.
ते मिक्सरमध्ये घालून नाहीतर कुटून आपण त्याची पिठीसाखर बनवू शकतो. म्हणजे त्या कणांचा आकार खूप लहान झालेला असतो. समजा आपण ती साखर पाण्यात टाकली तर काय होईल? विरघळेल, बरोबर आहे. ते कण आपल्याला दिसतात का? नाहीं, पण पाणी मात्र गोड लागते. याचा अर्थ साखरेचा गुणधर्म पाण्यात आहेच आणि साखर या स्थायूचे कण डोळ्यांना दिसत नाहीत इतके सूक्ष्म झालेले आहेत.
पाणी आपण नेहमीच पहातो. ते द्रवरूप असते. ते समजा लोटीतून भांडयात ओतले. पाण्याने भांडयाचा आकार घेतला पण पाण्याचे कण कुठे दिसतात का? नाहीं. तेच पाणी चहा बनविण्यासाठी पातेल्यात घेऊन तापत ठेवले. थोड्या वेळाने ते उकळू लागते आणि त्यातून वाफ म्हणजे अर्थातच पाण्याचे बारीक कण हवेत मिसळून दिसेनासे होतात. म्हणजे द्रवसुद्धा अतिशय सूक्ष्म कणांचा बनला आहे.
आपल्या भोवतालची हवा ही सुद्धा सूक्ष्म कणांची बनली आहे. हवा हलली कीं वारा येतो तेव्हा आपल्याला त्या सूक्ष्म कणांचे अस्तित्व जाणवते, पटतंय?
हवा उपलब्ध असलेली सर्व जागा, त्याचे सर्व आकारमान व्यापते. असं कां बरं होत असावं? कारण वायूच्या अतिसूक्ष्म कणांमध्ये आकर्षण बल नगण्य असते. पाणी आपला आकार भांड्यानुसार बदलते पण आकारमान स्थिर ठेवते. कारण द्रवाच्या बाबतीत त्याच्या कणांमधील आकर्षण बल मध्यम प्रतीचे असते. स्थायूंच्याबाबतीत मात्र त्यांचा आकार व आकारमान कायम रहाते कारण त्यांच्या कणांमधील आकर्षण बल जोमदार असते. हे अणू ज्या मूलद्रव्याचे बनले आहेत त्या मुलद्रव्यांचे वर्गीकरण आधुनिक पद्धतीने करताना त्यांच्या अणुअंकाच्या वाढत्या क्रमानुसार केले जाते. मग सांगा बरं; अणुअंक 1 असेल म्हणजे H तर ते मूलद्रव्य कोणत्या कक्षेत जाईल? कमीतकमी उर्जेची कक्षा = 1s, पुढे He चा अणूअंक 2 असेल तर 1s मध्येच, समजलं का? Na चा अणूअंक 11: इलेक्ट्रॉन 11.
मोजा बरं : 1s2, 2s2, 2p6 म्हणजे 10 इलेक्ट्रॉनस् झाले. (1s2 यात वरती लिहिलेली संख्या इलेक्ट्रॉन्स दर्शविते 2+2+6=10) आता उरलेला 1 कुठे जाईल? 3s मध्ये. म्हणजे 3s1बरोबर ना? आता Na चे इलेक्ट्रॉन संरूपण असे झाले :1s2,2s2,2p6,3s1.
आवर्तसारिणीत मूलद्रव्यांची मांडणी करतांना त्या त्या मूलद्रव्यातील इलेक्ट्रॉन संरूपण(Electronic Configuration) कसे लिहायचे हे आपण सोडियम (Na) या मूलद्रव्याच्या उदाहरणावरून पाहिले. कळले ना? OK?
मग आमचा ‘आवर्त सारणीचा’ लेख तुम्हाला चांगलाच समजेल.
रिचर्ड फेनमन यांनी म्हटलेच आहे कीं पदार्थ अणूंचे बनलेले असतात, ते कायम गतिमान अवस्थेत असतात, त्या अणूंमध्ये आकर्षण असते पण अतिजवळ आले (squeeze) की त्यांच्यात प्रतिकर्षण होते. जवळजवळ सर्वच गोष्टींचा संबंध अणूशीच निगडित.
जेथे तेथे अणूच.
Send us your feedback
All diagrams, pictures, tables etc. are from websites on Internet. We are thankful to all these sources.
Vidnyanvahini is a Non-Governmental Organisation (NGO) and this entire write up is for students, teachers and general public, free of charge.
IT IS NOT FOR ANY COMMERCIAL USE.
