रसायन शास्त्र (Chemistry) 
9 September 2020
द्रव्याचे स्वरूप (भाग 1)
28 October 2020
द्रव्याचे स्वरूप (भाग 2)
4 November 2020
अणू संरचना (भाग - 1)
25 December 2020
अणू संरचना (भाग - 2)
8 January 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 1)
28 April 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 2)
13 May 2021
धातू व अधातू
5 September 2021
धातू व अधातूचे रासायनिक गुणधर्म
19 September 2021
बाबा, द्रव्याचे दोन प्रकाराने वर्गीकरण करतात. भौतिक स्थितीवर आधारीत वर्गीकरणानुसार द्रव्याचे स्थायू, द्रव, वायू हे तीन प्रकार पडतात. त्यांची माहिती द्रव्याचे स्वरूप भाग १ मध्ये तुम्ही मला दिलीत. आता द्रव्याचे, दुसऱ्या प्रकाराने पडणाऱ्या प्रकारांची माहिती देता कां?
संजू, फुलांचे गट तयार करताना तू दुसरा प्रकार सांगितलास तो म्हणजे फुलांच्या प्रकारानुसार. कारण गुलाबाच्या फुलांची रचना, त्याचे इतर गुणधर्म हे शेवंतीच्या फुलांपेक्षा वेगळे असतात. तसेच द्रव्य वर्गीकरणाची दुसरी पध्दत ही द्रव्याच्या रासायनिक घटनेवर म्हणजे रासायनिक संघटनेवर आधारित आहे. यानुसार द्रव्याचे, मूलद्रव्य(Elements), संयुग(Compound) आणि मिश्रण(Mixtures) असे तीन प्रकार पडतात.
रासायनिक संघटनेवर आधारित म्हणजे काय हो बाबा?
अरे, द्रव्याचा लहान कण, अणू किंवा रेणू हे, त्या द्रव्यात एकसारखे आहेत की वेगवेगळे आहेत. यावरून द्रव्यांचे मूलद्रव्य ,संयुग व मिश्रण असे तीन प्रकार पडतात.
अणूंमधे प्रोटॉन, न्यूट्रॉन, इलेक्ट्रॉन हे अणूकण असतात. अणूतील प्रोटॉनच्या संख्येला त्या अणूचा अणुअंक म्हणतात. हे तुला माहित आहेच. ज्या पदार्थाचे रासायनिक प्रक्रियेने अपघटन करता येत नाही व त्या पदार्थामधील सर्व अणूंचा अणुअंक एकच असतो त्या पदार्थाला मूलद्रव्य म्हणतात. उदा. तांबे ,लोखंड, ऑक्सिजन ही मूलद्रव्ये आहेत. या मूलद्रव्यांबद्दल थोडी माहिती मी तुला नंतर देतो.
पाणी, मीठ ही आहेत संयुगे. संयुगाचा रेणू हा दोन किंवा जास्त मूलद्रव्यांच्या अणूंनी तयार होतो. उदा. मीठ. मिठाचा रेणू हा सोडियमचा एक अणू व क्लोरीनचा एक अणू यांच्यात रासायनिक अभिक्रिया होऊन तयार होतो. म्हणजे दोन भिन्न प्रकारच्या मूलद्रव्यांचे अणू मिठाच्या रेणूमधे असतात. आता दुसरे उदा. पाहू साखरेचे. साखरेचा रेणू हा बारा कार्बनचे अणू, बावीस हायड्रोजनचे अणू आणि अकरा ऑक्सिजनचे अणू, यांच्यात अभिक्रिया होऊन तयार होतो. संयुगाचा रेणू तयार होताना त्यातील मूलद्रव्यांचे प्रमाण ठराविक असते. हे सर्वात महत्वाचे होय.
म्हणजे बाबा, संयुगे ही दोन किंवा दोनापेक्षा जास्त मूलद्रव्य विशिष्ट प्रमाणात रासायनिक अभिक्रिया होऊन तयार होतात. बरोबर ना? मिश्रण म्हणजे काय?
अगदी बरोबर संजू. मिश्रण म्हणजे जेव्हा द्रव्य दोन किंवा अधिक भिन्न पदार्थांचे बनलेले असते तेव्हा त्याला मिश्रण म्हणतात. उदा. हवा. हवेमध्ये ऑक्सिजन, नायट्रोजन, कार्बन डाय-ऑक्साइड, धुळीचे कण, पाण्याची वाफ इत्यादी अनेक पदार्थ आढळून येतात. पण यांचे प्रमाण ठराविक नसते. तसेच पितळ हे तांबे व जस्त या दोन मूलद्रव्यांपासून तयार झालेले मिश्रण आहे. याला मिश्रण म्हणतात कारण यातील तांबे व जस्त यांच्यात रासायनिक अभिक्रिया घडत नाही तसेच त्यांचे प्रमाण निश्र्चित नसते.
मूलद्रव्य, संयुग व मिश्रण या प्रत्येक प्रकाराचे उपप्रकार पडतात. यासाठी आपण एक तक्ता तयार करू.
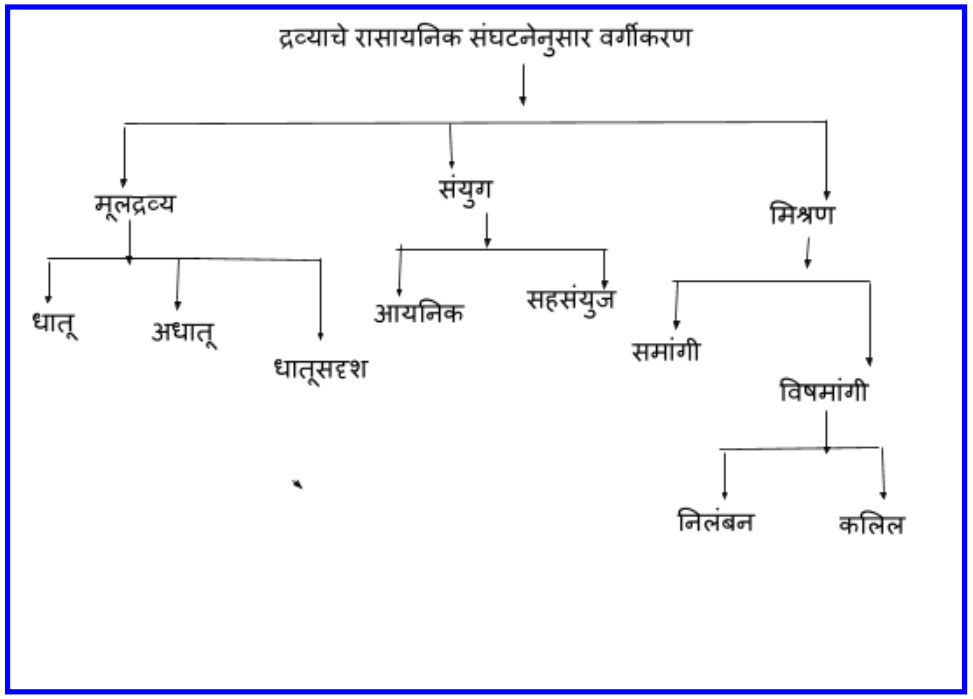
आपण आधी मुलद्रव्याबद्दल चर्चा करूयात. मी तुला मगाशी दोन मूलद्रव्यांची नावे सांगितली आहेत. येतील का सांगता तुला?
तांबे आणि लोखंड. बरोबर?
करेक्ट. तसेच ऑक्सिजन,नायट्रोजन, हायड्रोजन, सोडीयम, क्लोरीन,पारा,शिसे, युरेनियम ही मूलद्रव्यांची आणखीन काही उदाहरणे. बऱ्याच धातू व राजवायूंची मूलद्रव्ये ही एक अणू रेणूंच्या स्वरूपात आढळून येतात. उदा. तांब्याचा अणू, लोखंडाचा अणू, क्लोरिनचा अणू. या मूलद्रव्यांच्या अणूंना स्वतंत्र अस्तित्व असते. म्हणून त्यांना एक अणू रेणू (Monoatomic molecule) असे म्हणतात. व ते Cu, Fe, Cl असे दर्शवितात. परंतु काही मूलद्रव्यांच्या दोन किंवा अधिक अणूंच्या संयोगातून त्या मूलद्रव्याचे रेणू तयार होतात. अशी मूलद्र्व्ये बहू - अणू - रेणू (Polyatomic molecule) अवस्थेत असतात. उदा. ऑक्सिजन, हायड्रोजन हे नेहमी द्वि - अणू रेणूं(Diatomic molecule) च्या स्वरूपात आढळून येतात. म्हणजे ऑक्सिजनचे दोन अणू एकत्र येऊन ऑक्सिजनचा एक रेणू तयार होतो. तसेच हायड्रोजनचे दोन अणू एकत्र येऊन हायड्रोजनचा रेणू तयार होतो. ते O2, H2 असे दर्शवितात. गंधक सामान्यपणे याचे आठ अणू एकत्र येऊन रेणू तयार होतो व तो S8 असा दर्शविला जातो. संजू, एक अणू रेणू, द्वि अणू रेणू, या संकल्पना स्प्ष्ट होण्यासाठी म्हणून ही चित्रे बघ. पण कोणत्याही अणू/ रेणूला रंग नसतो हे लक्षात ठेव.

मूलद्रव्यामध्ये फक्त त्याच मूलद्रव्याचे अणू असतात. त्यामुळे मूलद्रव्यांचे रासायनिक प्रक्रियेने अपघटन करता येत नाही. वेगवेगळ्या मूलद्रव्यांचे अणू/ रेणू हे वेगवेगळे असतात.
बाबा, तक्त्याप्रमाणे मूलद्रव्यांचे तीन गटात वर्गीकरण केले आहे. त्यामुळे मूलद्रव्यांचा अभ्यास करणे सोईचे झाले. ते तीन प्रकार म्हणजे १) धातू(Metals) २) अधातू(Non metals) व ३) धातुसदृश्य(Metalloid).
बाबा, मानवी संस्कृतीच्या उत्क्रांतीत ताम्रयुग, लोहयुग होऊन गेले. म्हणजे या धातूंमध्ये असे काही गुणधर्म आहेत की ज्यामुळे त्यांचा उपयोग भांडी, नाणी, शस्त्रे, दागिने तयार करण्यासाठी केला जातो. बरोबर ना?
बरोबर संजू. धातू हे उष्णता, विद्युत सुवाहक( Good conductor of heat and electricity) असतात. धातूंना चकाकी (Lustre) असते. तसेच तन्यता (Ductility) आणि वर्धनीयता (Malleability) हे दोन गुणधर्म आढळतात. तन्यता म्हणजे तार काढणे आणि वर्धनीयता म्हणजे धातूंचे पत्र्यात रुपांतर करता येणे.
बाबा, जसे पूर्ण-अपूर्ण, शांत- अशांत हे विरुद्धार्थी शब्द आहेत तसेच धातू व अधातू . त्यामुळे धातूंमध्ये जे गुणधर्म आहेत ते अधातूं मध्ये आढळून येत नाहीत. बरोबर ना!
बरोब्बर. अधातूंना चकाकी नसते. अधातू मध्ये तन्यता, वर्धनीयता हे गुणधर्म आढळून येत नाहीत. ते उष्णता व विद्युत यांचे दुर्वाहक असतात. पण यामध्ये आपल्याला काही अपवाद आढळून येतात. म्हणतात ना, अपवादाशिवाय नियम सिध्द होत नाही. संजू, या गुणधर्मांशिवाय इतरही विविध भौतिक व रासायनिक गुणधर्म धातू - अधातूं मध्ये आढळून येतात. आपण एक दिवस या धातू- अधातूंची विस्तृत माहिती करून घेऊ.
चालेल बाबा. आता हा जो तिसरा प्रकार आहे धातुसदृश, त्याच्या नावावरून मला असं वाटतंय की ते धातू सारखे दिसत असावेत.
बरोबर. धातुसदृश्य(Metalloid) हे दिसतात धातूं सारखे पण त्यांचे रासायनिक गुणधर्म हे बहुतांशी अधातूं सारखे असतात म्हणून त्यांना धातुसदृश असे म्हणतात. याची उदाहरणे म्हणजे सिलिकॉन, आर्सेनिक, जर्मेनियम, अँटिमनी, बोरॉन इत्यादी. संजू, एकविसाव्या शतकाला सिलिकॉन युग असे म्हणतात. सिलिकॉन हा अर्धसंवाहक म्हणून उत्तम काम करतो. त्याचा उपयोग कॉम्प्युटर, मोबाईल मध्ये ज्या चिप्स वापरतात त्यांच्यामध्ये केला जातो. सिलिकॉन हे ठिसूळ, गडद करड्या रंगाचे, स्फटिकरचना व धातूसारखी चमक असलेले धातूसदृश आहे. त्याचा द्रवणांक १,४२००C असून उत्कलन बिंदू २,३५५०C आहे.

बाबा, पण दरवेळी मूलद्रव्यांची नावे लिहीत असताना जर्मेनियम, सोडियम, पोटॅशिअम अशी मोठी मोठी नाव लिहीत बसावी लागणार.
अरे याचा विचार शास्त्रज्ञांनी पण केला बरं का. आता माझंच बघ ना. मी दरवेळेला तुला संजीव असं म्हणतो का? नाही. तसंच मूलद्रव्ये दर्शविण्यासाठी सुद्धा अशीच पद्धत वापरली गेली. सर्वप्रथम बर्झेलिअस या शास्त्रज्ञाने ही पद्धत सुरू केली. त्यांनी मूलद्रव्यांच्या नावांचा संक्षेप करून संज्ञा तयार केली. मूलद्रव्यांच्या नावांच्या संक्षिप्त रूपास संज्ञा(Symbol) म्हणतात. इंग्रजी मुळाक्षरांचा वापर करून संज्ञा दर्शवितात.
सामान्यपणे मूलद्रव्यांच्या संज्ञा इंग्रजी नावावरून तयार करण्यात आल्या. पण काही मूलद्रव्यांच्या संज्ञा या त्यांच्या लॅटिन नावावरून करण्यात आल्या. प्रथम आपण इंग्रजी नावावरून मूलद्रव्यांच्या संज्ञा करताना काय काय विचार केला गेला ते पाहू. उदा. कार्बन याचे इंग्रजीमध्ये स्पेलिंग होते carbon . म्हणून कार्बनची संज्ञा करताना त्याचे पहिले अक्षर कॅपिटल C हे वापरले गेले. त्यामुळे कार्बन ची संज्ञा झाली C. कॅल्शियम या मूलद्रव्याचे स्पेलिंग आहे Calcium म्हणून त्याची संज्ञा करताना पहिली दोन अक्षरे वापरली गेली. नाहीतर कार्बन आणि कॅल्शिअम यांच्यामध्ये गोंधळ झाला असता. या दोन अक्षरातील पहिले अक्षर हे कॅपिटल मध्ये लिहितात तर दुसरे इंग्रजी अक्षर हे लहान लिपी मध्ये लिहितात. म्हणून कॅल्शियमची संज्ञा झाली Ca. कॅडमियम या मूलद्रव्याचे स्पेलिंग होते Cadmium. म्हणून याची संज्ञा तयार करताना शास्त्रज्ञांनी पहिली दोन अक्षरे न घेता पहिले आणि तिसरे अक्षर घेतले. म्हणून कॅडमियम ची सज्ञा झालीCd. नाहीतर कॅल्शियम आणि कॅडमियम यांच्यात गोंधळ झाला असता.
आता लॅटिन नावावरून मूलद्रव्यांच्या झालेल्या संज्ञा पाहू. तांबे म्हणजेच कॉपर. याची संज्ञा आहे Cu. ती त्याच्या लॅटीन Cuprum क्युप्रम या नावावरून तयार करण्यात आली. तसेच सोडियमची संज्ञा Na, त्याचे लॅटिन नाव Natrium नॅट्रीयम यावरून करण्यात आली. पोटॅशियम चे लॅटीन नाव आहे Kalium कॅलीयम म्हणून त्याची संज्ञा आहे K. लोखंड म्हणजे आयर्न चे लॅटिन नाव आहे फेरम म्हणून त्याची संज्ञा आहे Fe.
बाबा, पण या मूलद्रव्यांची नावे कशावरून आली?
संजू, काही मूलद्रव्यांची नावे देशावरून, रंगावरून, शास्त्रज्ञांच्या नावांवरून आली आहेत. त्याबद्दल खूपच मनोरंजक माहिती आहे. त्याबद्दल आपण नंतर कधीतरी बोलू. आता द्रव्याच्या दुसऱ्या प्रकाराकडे जाऊयात. मी तुला त्या प्रकाराची काही उदाहरणे सांगितली होती. ते सांग बर मला.
मीठ, पाणी, ही संयुग या प्रकारात येतात. अगदी बरोबर. या संयुगांची काही वैशिष्ट्ये पाहुयात. संयुगांवर कोणताही प्रभार नसतो. संयुगांचे रासायनिक प्रक्रियेने अपघटन करता येते. पाण्याचे रासायनिक प्रक्रियेने अपघटन केले असता हायड्रोजन व ऑक्सिजन ही दोन मूलद्रव्ये मिळतात. मिठाचे रासायनिक प्रक्रियेने अपघटन केले असता सोडियम व क्लोरिन ही दोन मूलद्रव्ये मिळतात.
संयुगांचे रासायनिक प्रक्रियेने अपघटन केल्यानंतर दोन किंवा दोनापेक्षा जास्त मूलद्रव्ये मिळतात. म्हणजेच संयुगांचे रेणू हे दोन किंवा दोनापेक्षा जास्त मूलद्रव्ये एकत्र येऊन तयार होतात.

पण ही मूलद्रव्ये एकत्र येताना, विशिष्ट प्रमाणातच एकत्र येतात. उदा. पाणी तयार होताना हायड्रोजनचे दोन अणू व ऑक्सिजनचा एक अणू एकत्र येतात. मीठ तयार होताना सोडियमचा एक अणू व क्लोरिनचा एक अणू एकत्र येतात. हायड्रोक्लोरीक ॲसिड मध्ये एक हायड्रोजनचा अणू व एक क्लोरीनचा अणू असतो. मिथेन मध्ये एक कार्बनचा अणू व चार हायड्रोजनचे अणू असतात.

बाबा, माझ्या माहितीप्रमाणे हायड्रोजन हा वायू स्वतः जळतो आणि ऑक्सिजन ज्वलनाला मदत करतो, पण त्यापासून तयार झालेले पाणी आग विझविते. हे कसं काय?
योग्य प्रश्न संजू! संयुगाचे गुणधर्म हे त्याच्या घटक मूलद्रव्यांच्या गुणधर्मापेक्षा पूर्णपणे वेगळे असतात. म्हणूनच सोडियम हवेत ठेवला असता पेट घेतो आणि क्लोरीन विषारी आहे, पण ही दोन मूलद्रव्ये एकत्र येऊन तयार होणारे मीठ आपण रोज खातो.
ओ कसलं भारी ना! पण बाबा, हे असे दोन किंवा जास्त मूलद्रव्य एकत्र येतात, त्यांच्यात अभिक्रिया होते म्हणजे नक्की काय? ते कसे एकत्र येतात?
योग्य शंका विचारलीस. प्रत्येक अणूच्या मध्यभागी एक केंद्रक असते. त्या केंद्रकाभोवती असणाऱ्या विविध कक्षेत इलेक्ट्रॉन्स फिरत असतात. प्रत्येक कक्षेत किती इलेक्ट्रॉन्स फिरतात हे बोहरने 2n2 (n म्हणजे कक्षा क्रमांक) या सूत्राने निश्चित केले आहे. कोणताही अणू स्थिर होण्यासाठी त्याच्या बाह्यतम कक्षेत जास्तीत जास्त आठ इलेक्ट्रॉन्स लागतात. याला अणूची अष्टक स्थिती म्हणतात. पण एखाद्या अणूची पहिली कक्षा हीच बाह्यतम कक्षा असेल तर मात्र त्या कक्षेत जास्तीत जास्त दोन इलेक्ट्रॉन्स असतील तर ती कक्षा स्थिर होते. याला अणूची द्विक स्थिती म्हणतात.
प्रत्येक अणू द्विक किंवा अष्टक स्थिती प्राप्त करून, स्थिर होण्याचा प्रयत्न करीत असतो. अणू दोन प्रकारांनी या स्थिती मिळविण्याचा प्रयत्न करतो. १) इलेक्ट्रॉन्सची पूर्णपणे देवाण-घेवाण करून. २) इलेक्ट्रॉन्स भागीदारीमध्ये घेऊन. यामुळे अणूंमध्ये रासायनिक बंध निर्माण होतात आणि अणू एकमेकांना जोडले, बांधले जातात.
ओ! असं आहे काय! म्हणून तुम्ही वरती संयुगांचे दोन उपप्रकार सांगितलेत. या रासायनिक बंधांच्या प्रकारावरून हे उपप्रकार पडले आहेत का?
येस. जेव्हा इलेक्ट्रॉन्सची पूर्णपणे देवाण-घेवाण होऊन बंध तयार होतो तेव्हा त्या बंधाला आयनिक बंध(Ionic bond) म्हणतात. या बंधामुळे जी संयुगे तयार होतात त्यांना आयनिक संयुगे(Ionic compound) म्हणतात. याचे आपण एक उदाहरण घेऊ म्हणजे तुला ते लवकर कळेल. मीठ. याचे रसायन शास्त्रातले नाव आहे सोडियम क्लोराईड. या नावावरून मीठ हे संयुग कोणती दोन मूलद्रव्ये एकत्र येऊन तयार झाले असेल हे तू सांगू शकतोस का?
सोडियम क्लोराईड. म्हणजे सोडियम व क्लोरिन ही दोन मूलद्रव्य एकत्र येऊन मीठ म्हणजेच सोडियम क्लोराइड तयार झाले असेल.
बरोबर सोडिअम व क्लोरिन यांच्यामध्ये आयनिक बंध कसा तयार होतो हे चित्राच्या सहाय्याने आपण पाहू.
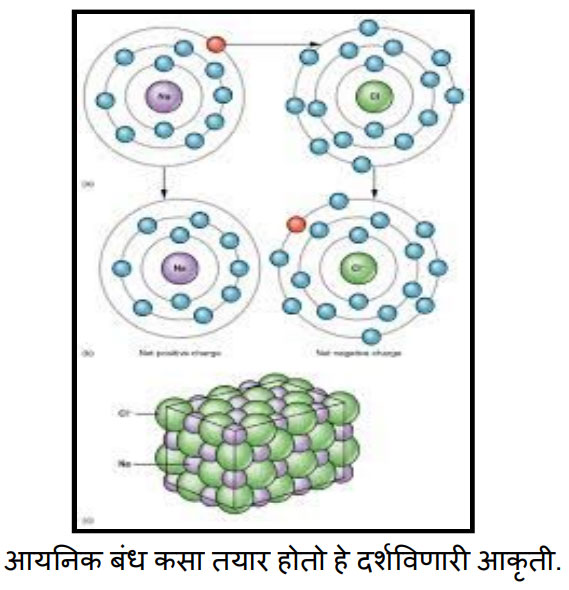
संजू , चित्रातील रंग हे आकृती स्पष्ट व्हावी म्हणून दिलेले आहेत .प्रत्यक्षात असे रंग केंद्रक किंवा इलेक्ट्रॉन्सना नसतात. ज्याचे केंद्रक जांभळ्या रंगाने दाखवले आहे तो सोडियमचा अणू आहे. तर ज्याचे केंद्रक हिरव्या रंगाने दाखवले आहे तो क्लोरिनचा अणू आहे. निळ्या रंगांनी इलेक्ट्रॉन्स दाखविले आहेत. मात्र एक इलेक्ट्रॉन लाल रंगाने दाखवला आहे. तो का ते तुला नंतर कळेलच. चित्रावरून तू मला काही गोष्टी सांगू शकतोस कां?
त्यासाठी मला जरा पाच मिनिटाचा वेळ देता कां? जरूर. मी पण माझं थोडं काम करत बसतो.
बाबा, मला या चित्रातून काय कळलंय ते मी आधी सांगतो. सोडियमच्या अणूत एकूण 11 इलेक्ट्रॉन्स दिसताय. त्याच्या बाह्यतम कक्षेत एकच इलेक्ट्रॉन आहे. तो लाल रंगाने दाखवला आहे. क्लोरीनच्या अणूत एकूण 17 इलेक्ट्रॉन्स दिसत आहेत. त्याच्या बाह्यतम कक्षेत सात इलेक्ट्रॉन्स आहेत. आपापली अष्टक स्थिती पूर्ण करण्यासाठी म्हणून सोडियम त्याच्या बाह्यतम कक्षेतला एक इलेक्ट्रॉन क्लोरीनला देतोय. म्हणून तो लाल रंगाने दाखवला आहे.
अरे वा ! क्या बात है संजू! एकदम परफेक्ट!
पण बाबा, त्या सोडियमच्या खाली परत सोडियम अणूची आकृती दाखवली आहे आणि क्लोरीनच्या खाली पण क्लोरीनच्या अणूची आकृती दाखवली आहे. कशासाठी?
संजू, सोडियम आणि क्लोरीन अणूच्या या दोन्ही आकृत्या सारख्याच आहेत का रे ?
नाही . खालच्या सोडियम अणूमध्ये मध्ये एक इलेक्ट्रॉन कमी आणि क्लोरीनच्या अणू मध्ये एक इलेक्ट्रॉन जास्त दिसतोय.
बरोबर. संजू, तुला माहिती आहे की अणूवर कोणताही प्रभार नसतो. अणू मध्ये धन प्रभारित प्रोटॉन व ऋण प्रभारित इलेक्ट्रॉनची संख्या सारखी असल्यामुळे अणू हा उदासीन असतो. मग आता मला सांग, सोडियम अणूनी एक इलेक्ट्रॉन दिल्यावर व क्लोरीनच्या अणूने एक इलेक्ट्रॉन घेतल्यावर ते दोन्ही उदासीनच राहतील का?
ओ! बरोबर. सोडियमच्या अणूने एक इलेक्ट्रॉन दिल्यामुळे त्याच्यामधील इलेक्ट्रॉनची संख्या एक ने कमी होईल पण प्रोटॉन मात्र पहिल्याइतकेच राहतील. आणि क्लोरीनच्या अणूने एक इलेक्ट्रॉन घेतल्यामुळे त्याच्यामधील इलेक्ट्रॉनची संख्या एक ने वाढेल, मात्र प्रोटॉनची संख्या पहिल्याइतकीच राहील.
करेक्ट ! त्यामुळे आता सोडियमच्या अणूवर एक धन प्रभार येईल आणि क्लोरीनच्या अणूवर एक ऋण प्रभार येईल. ज्या अणूवर प्रभार असतो त्यांना आयन म्हणतात. धन प्रभारित अणूंना धन आयन म्हणतात व ऋण प्रभारित अणूंना ऋण आयन म्हणतात. आयनिक बंधामध्ये अणूंपासून आयन तयार होतात म्हणून त्याला आयनिक बंध असे म्हणतात. म्हणून या बंधाने तयार होणाऱ्या संयुगांना आयनिक संयुगे म्हणतात.
बाबा , मूलद्रव्य जशी संज्ञेने दाखवतात तसे हे आयन कसे लिहितात?
अरे आयन म्हणजे प्रभारित अणू. त्यामुळे त्या मूलद्रव्याच्या अणूसाठी जी संज्ञा वापरतात तीच त्या मूलद्रव्यांच्या आयनांसाठी वापरतात. फक्त आयन प्रभारित असल्यामुळे त्यावरील प्रभार त्या संज्ञेच्या डोक्यावर धन किंवा ऋण चिन्ह देऊन दर्शवितात. जर तो धन प्रभारित असेल तर धन चिन्ह काढतात व ऋण प्रभारित असेल तर ऋण चिन्ह काढतात. तसेच तो अणू जितके इलेक्ट्रॉन देतो किंवा घेतो ती संख्या धन किंवा ऋण चिन्हाच्या पुढे लिहितात. उदा. सोडियम एक इलेक्ट्रॉन देतो म्हणून त्याचा धन आयन ,ह्याला कॅटायन असेही म्हणतात तो Na+1 असा लिहितात. तर क्लोरीन इलेक्ट्रॉन घेतो म्हणून क्लोरिनचा ऋण आयन याला अँनायन असेही म्हणतात तो Cl-1 या पद्धतीने लिहितात. मॅग्नेशियम 2 इलेक्ट्रॉन देतो म्हणून त्याचा कॅटायन Mg+2 या पद्धतीने लिहितात. तर ऑक्सिजन 2 इलेक्ट्रॉन घेतो म्हणून त्याचा अँनायन O-2 या पद्धतीने लिहितात.
म्हणजे इलेक्ट्रॉन दिले की धन आयन म्हणजेच कॅटायन तयार होतो व इलेक्ट्रॉन घेतले की ऋण आयन म्हणजेच अँनायन तयार होतो.
समजलं. खाली आणखीन एक आकृती आहे. ती सोडियम क्लोराइड म्हणजे मिठाच्या रेणूची आकृती दाखविली आहे. बाबा, आता मला इलेक्ट्रॉनची भागीदारी करून जो सहसंयुज बंध तयार होतो त्याबद्दल माहिती सांगा ना!
हे बघ, तुम्ही क्रिकेट खेळताना एक जण बॉल घेऊन येतो. दोघं कोणीतरी बॅट घेऊन येतात. आणखीन कोणीतरी स्टंप घेऊन येतो आणि हे सगळं साहित्य, तुम्ही सर्वजण वापरून क्रिकेट खेळता. एखाद्या व्यवसायाचं उदाहरण घे. काही वेळा, व्यवसाय हा दोघं तिघं एकत्र येऊन म्हणजे सर्वांच भांडवल वापरून, भागीदारीमध्ये करतात. तसंच हे इलेक्ट्रॉन्स आपापल्या अणूची द्विक किंवा अष्टक स्थिती पूर्ण करण्यासाठी भागीदारीमध्ये इलेक्ट्रॉन वापरतात. एकमेकांच्या सहकार्याने आपापले अणू स्थिर करून घेतात म्हणून या बंधाला सहसंयुजा बंध(Covalent bond) म्हणतात व या बंधामुळे निर्माण होणाऱ्या संयुगांना सहसंयुज संयुगे (Covalent compound)असे म्हणतात. पाणी हे संयुग या सहसंयुज बंधाने तयार झालेले आहे. पाणी तयार होताना हायड्रोजनचे दोन अणू व ऑक्सिजनचा एक अणू यांच्यामध्ये इलेक्ट्रॉनची भागीदारी होते. हे ह्याचे चित्र. लाल रंगाचे केंद्रक असलेला ऑक्सिजनचा अणू व उरलेले दोन्ही हायड्रोजनचे अणू आहेत. त्यावरून तुला काय काय कळल ते सांग.
सहसंयुज बंध कसा तयार होतो हे दर्शविणारी आकृती
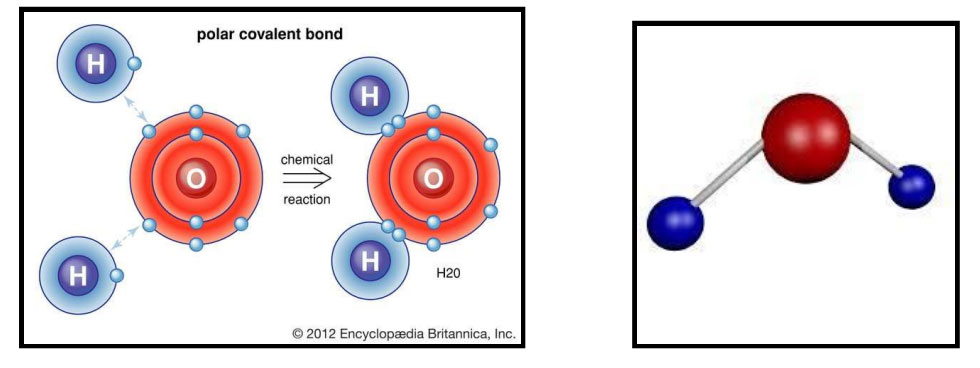
हे बघा हं, हायड्रोजनच्या अणूंना एकच कक्षा आहे. त्या एका कक्षेत एकच इलेक्ट्रॉन फिरतोय. ऑक्सिजन अणूच्या बाह्यतम कक्षेत सहा इलेक्ट्रॉन्स आहेत. कळलं. हायड्रोजनच्या दोन अणूतील एक-एक इलेक्ट्रॉन ऑक्सिजनच्या एका अणूतील, एक-एका इलेक्ट्रॉन बरोबर भागीदारी करत आहेत. म्हणजे इलेक्ट्रॉन आपापसात वाटून घेत आहेत. अशा तऱ्हेने हायड्रोजनचे दोन अणू आणि ऑक्सिजनचा एक अणू आपापली द्विक आणि अष्टक स्थिती पूर्ण करून घेत आहेत. आणि शेजारची जी आकृती आहे, ती त्या पाण्याच्या रेणूची आहे. बाबा , वरील दोन्ही उदाहरणांवरून मला असं वाटतं की प्रत्येक अणू किती इलेक्ट्रॉनची देवाण-घेवाण करणार किंवा किती इलेक्ट्रॉन्स भागीदारीत वाटून घेणार हे त्या अणूच्या बाह्यतम कक्षेत असलेल्या इलेक्ट्रॉनच्या संख्येवर अवलंबून असतो हो ना.
शंभर टक्के बरोबर ! यालाच एका अणूची दुसऱ्या अणूबरोबर संयोग पावण्याची क्षमता म्हणतात. एखाद्या मूलद्रव्याच्या अणूची दुसऱ्या अणूंबरोबर संयोग पावण्याच्या क्षमतेला संयुजा (Valency) म्हणतात. संयुजा ही विशिष्ट अंकाने दर्शवितात. हा अंक म्हणजे एका अणूने इतर अणूंबरोबर केलेल्या रासायनिक बंधांची संख्या होय. अणूच्या बाह्यतम कक्षेला संयुजा कक्षा (Valence shell) म्हणतात आणि बाह्यतम कक्षेतील इलेक्ट्रॉन्सना संयुजा इलेक्ट्रॉन (Valence electrons) म्हणतात. म्हणजे बघ, सोडियम अणूमध्ये तिसरी कक्षा ही बाह्यतम कक्षा आहे म्हणून त्या तिसर्या कक्षेला संयुजा कक्षा म्हणतात. त्या कक्षेत एक इलेक्ट्रॉन आहे. त्या इलेक्ट्रॉनला संयुजा इलेक्ट्रॉन म्हणतात. सोडियम एक इलेक्ट्रॉन देतो म्हणून सोडियमची संयुजा एक आहे. मॅग्नेशियमच्या बाह्यतम कक्षेत दोन इलेक्ट्रॉन्स असतात. मॅग्नेशियम हे दोन इलेक्ट्रॉन देतो म्हणून मॅग्नेशियमची संयुजा दोन. आता ऑक्सिजनचे उदाहरण घेऊ. ऑक्सिजन अणू मध्ये दुसरी कक्षा की सर्वात बाह्यतम कक्षा आहे. म्हणून दुसरी कक्षा ही संयुजा कक्षा. त्या कक्षेत एकूण सहा इलेक्ट्रॉन्स आहेत. या इलेक्ट्रॉन्सना संयुजा इलेक्ट्रॉन म्हणतात. ऑक्सिजन अष्टक स्थिती पूर्ण करण्यासाठी दोन इलेक्ट्रॉन घेतो म्हणून ऑक्सिजनची संयुजा दोन. क्लोरीन अणूच्या बाह्यतम कक्षेत सात इलेक्ट्रॉन्स आहेत. अष्टक पूर्ण करण्यासाठी तो एक इलेक्ट्रॉन घेतो म्हणून त्याची संयुजा एक.
म्हणजे बाबा, संयुजा इलेक्ट्रॉनची संख्या चार किंवा त्यापेक्षा कमी असेल तर त्या मूलद्रव्याची संयुजा ही त्या संयुजा इलेक्ट्रॉनच्या संख्येएवढी असते. पण जर संयुजा इलेक्ट्रॉनची संख्या चार किंवा त्यापेक्षा जास्त असेल तर अष्टक पूर्ण होण्यासाठी जितके इलेक्ट्रॉन्स कमी पडतात तेवढी त्या मूलद्रव्याची संयुजा.
बाबा, जसं मूलद्रव्य दर्शविण्यासाठी संज्ञा वापरतात तसं, संयुगांची नावे कशी लिहितात?
संजू, संयुगांची नावे रेणुसूत्राने लिहितात. ही रेणुसूत्र लिहिणे एकदम सोपे आहे. त्या त्या संयुगांचे नाव लिहिताना ते ज्या आयन किंवा मूलकांपासून तयार झाले आहे त्यांच्या संज्ञा लिहावयाच्या. पण एक महत्त्वाचे म्हणजे त्यांच्या संयुजा पण तिथे लिहाव्या लागतात बरं का.
बापरे! म्हणजे संयुजा पाठ पाहिजेत.
अरे त्यांचा सराव केला की त्या राहतात लक्षात. थांब, आपण दोन तक्ते करू. पहिला धन आयन/मूलकांचा व दुसरा ऋण आयन/ मूलकांचा. म्हणजे तुला सोपं जाईल.
धन आयन/ मूलक
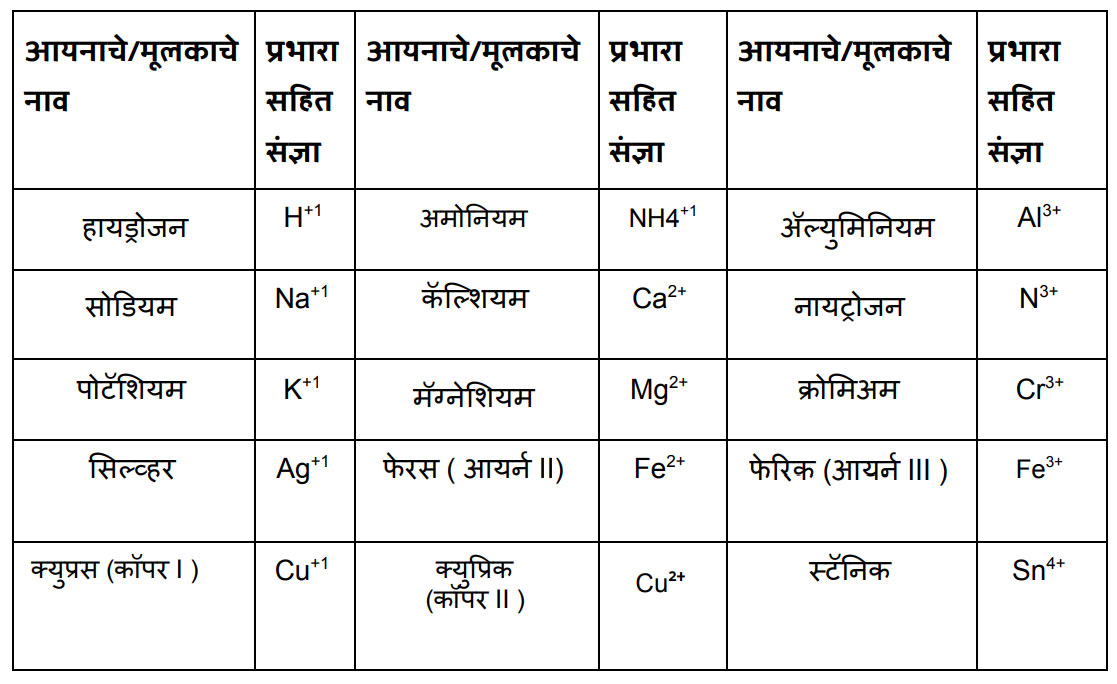
ॠण आयन / मूलक

इथे मला काही अणूंचा गट दिसत आहे. तसंच क्युप्रिक असे लिहून कंसात कॉपर व रोमन लिपीत दोन आकडा लिहिला आहे. फेरस लिहून त्यापुढे कंसात आयर्न व रोमन लिपीत तीन आकडा लिहिला आहे. असं का?
संजू, या मूलकांचे दोन गटात वर्गीकरण करतात. १) एकच अणू असलेली म्हणजे साधी मूलके जसे Al3+,Ca2+, K+ ,O2-, S2-इत्यादी. २) अणूंचा गट असलेली मूलके. त्यांना संयुक्त मूलक म्हणतात जसे NH4+, CO3 2-, OH- इत्यादी.
आता कॉपर व आयर्न या दोन ठिकाणी कंसात रोमन अंक कां लिहिले आहेत ते सांगतो. काही मूलद्रव्यांचे अणू वेगवेगळ्या परिस्थितीत वेगवेगळ्या संख्येने इलेक्ट्रॉन देतात किंवा घेतात. अशा वेळी ती मूलद्रव्य एकापेक्षा जास्त संयुजा दाखवितात. त्याला परिवर्ती संयुजा(Variable valency) म्हणतात. आयर्न 2 व 3 अशी परिवर्ती संयुजा दर्शवतो. कॉपर 1 व 2 अशी परिवर्ती संयुजा दर्शवतो. कॉपरच्या इथे कंसात दोन अंक लिहिला आहे याचा अर्थ कॉपरची संयुजा दोन घ्यायची. आयर्नच्या इथे कंसात 3 अंक लिहिला आहे याचा अर्थ आर्यनची संयुजा 3 घ्यायची. या संयुजेप्रमाणे त्यांची नावे बदलतात.
ओ असं आहे कां!. आता या संयुजे वरुन रेणुसूत्र कशी लिहायची ते सांगा ना.
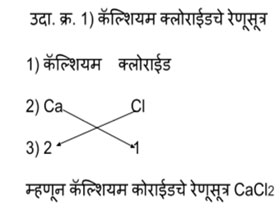
संयुगे तयार होताना नेहमी कॅटायन आधी लिहितात आणि नंतर अँनायन लिहितात हे प्रथम लक्षात ठेव. समजा तुला कॅल्शियम क्लोराईड चे रेणुसूत्र लिहायचं आहेत तर प्रथम संयुगाचे नाव लिहून घे. कॅल्शियमच्या नावाखाली कॅल्शियमची संज्ञा लिहून काढ. क्लोराईडच्या नावाखाली त्याची संज्ञा लिहून काढ. या संज्ञा लिहीत असताना त्यांच्या डोक्यावरचा प्रभार लिहू नकोस. आता कॅल्शियमच्या संज्ञेखाली त्याची संयुजा लिही 2. क्लोराईडच्या संज्ञेखाली त्याची संयुजा लिही 1. संयुजा लिहीताना धन, ऋण ही चिन्हे लिहू नकोस. मूलकांची संख्या मिळवण्यासाठी बाणाने दर्शविल्याप्रमाणे तिरकस गुणाकार करायचा म्हणजे तुला कॅल्शियम क्लोराइड चे रेणूसूत्र मिळेल CaCl2.
हे तर एकदम सोप्प आहे.
संयुजेवरून रेणूसूत्रे कशी तयार करायची?
संजू, आता उदाहरण सोड्विताना तिरकस गुणाकाराची खूण न करताच सोडव बरं कां.
उदा. क्र.2) कॉपर(II) हायड्रॉक्साईडचे रेणूसूत्र
1) कॉपर हायड्रॉक्साईड
2) Cu OH
3) 2 1
संजू, एक महत्वाची गोष्ट म्हणजे OH हा संयुक्त मूलक असल्याने तो कंसात लिहून कंसाच्या खाली त्याची संयुजा लिहावी. म्हणजे कॉपर(II) हायड्रॉक्साईडचे रेणूसूत्र Cu(OH)2 असे येईल
उदा. क्र. 3) फेरस सल्फाइड्चे रेणूसूत्र.
1) फेरस सल्फाइड
2) Fe S
3) 2 2
वरील उदा.वरून पाहिले असता फेरस सल्फाइड्चे रेणूसूत्र येईल Fe2S2. पण रेणूसूत्रातील घटक अणूंची संख्या लहानात लहान व पूर्णांकी असावी म्हणून यातील अंकांना 2 ने भागून अंतिम रेणूसूत्र येईल FeS.
संजू, या रेणूसूत्रावरून बऱ्याच गोष्टी लक्षात येतात बरं कां! जरा विचार कर. आणि त्याचा एक तक्ताच करून दाखव. तोपर्यंत मी एक फेरी मारून येतो स्वयंपाक घरात!
रेणूसूत्रावरून कोणकोणत्या गोष्टी समजतात.
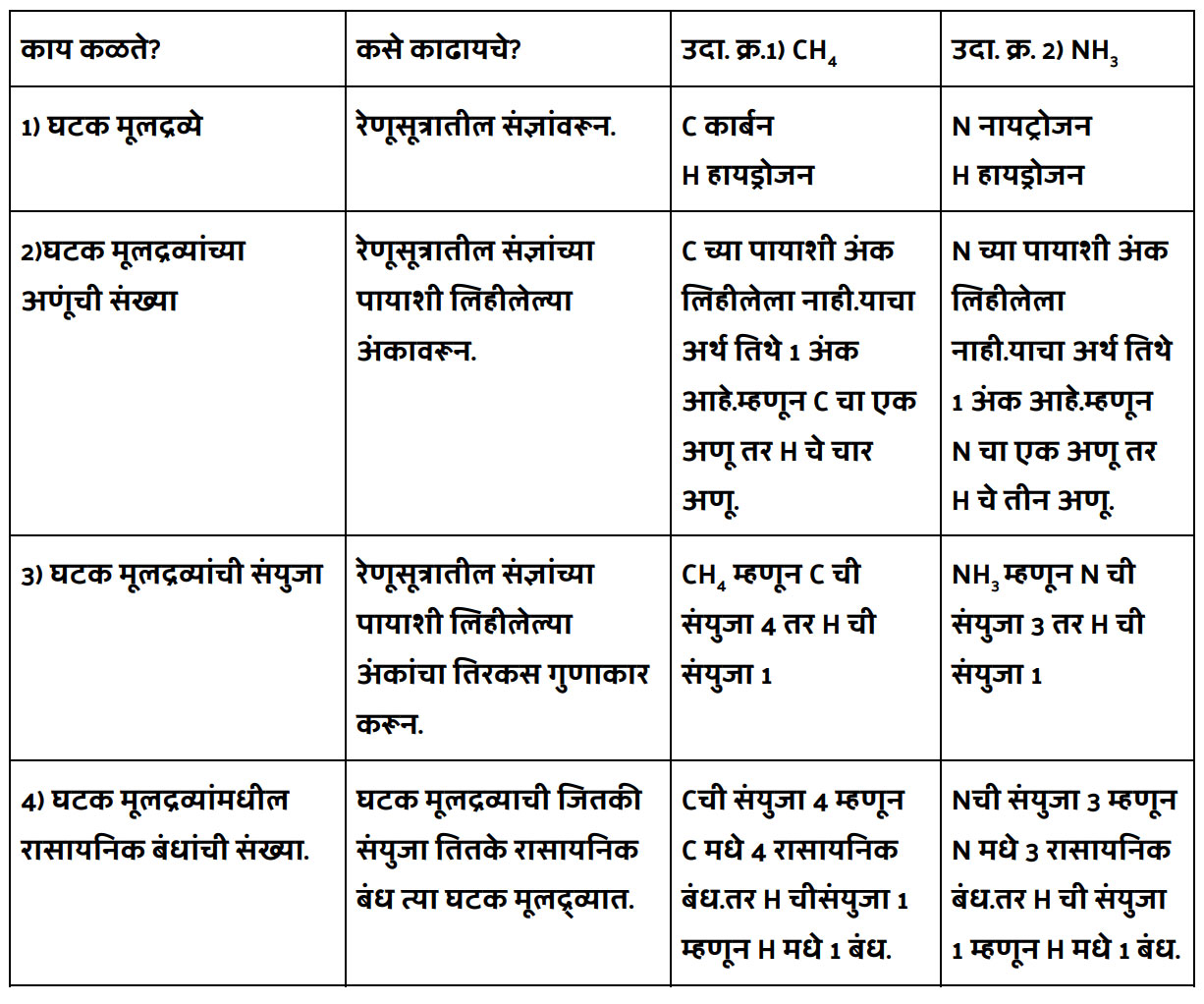
काय संजूबाबा झाला का तक्ता करून? अरे वा मस्त आणि बिनचूक केला आहेस की. हे घे भरपूर बोर्नव्हिटा घालून दिलेले दूध. आईने दिलंय लाडोबाला.
थँक्यू बाबा! कसा मस्त दिसतोय ना ग्लासच्या तळाशी बसलेला बोर्नव्हिटा. बाबा, तुमचे सरबत पूर्ण ग्लासभर एकसारखे दिसतय.
म्हणूनच संजू, माझे सरबत हे समांगी मिश्रण तर तुझे बोर्नव्हिटा असलेलं दूध विषमांगी मिश्रण.
ओ! म्हणजे सरबत आणि बोर्नव्हिटा असलेलं दूध ही दोन्ही वेगवेगळ्या प्रकारची मिश्रणे आहेत तर. द्रव्याचा रासायनिक घटनेवरून पडणारा तिसरा प्रकार मिश्रण.
एकदम करेक्ट! संजू, यावरून मिश्रणाची काही वैशिष्ट्य सांगू शकतोस का रे? बघ बरं प्रयत्न करून.
बाबा,प्लीज आधी थोडं दूध पितो, बोर्नव्हिटा खातो आणि मग सांगतो. या दुधामध्ये साखर आणि बोर्नव्हिटा आहे. आणि या दोघांचीही चव मला लागतीये. म्हणजे मिश्रणामध्ये दोन किंवा जास्त घटक पदार्थ असतात. म्हणजेच मिश्रणामध्ये दोन किंवा जास्त प्रकारचे अणू/रेणू असतात. पण या मिश्रणातील घटकांचे गुणधर्म मात्र तसेच राहतात असं दिसतंय. ते बदलले जात नाहीत. कारण मला दुधाची, साखरेची आणि बोर्नव्हिटाची पण चव कळतीये. बाबा, सरबतामध्ये सुद्धा पाणी, मीठ, साखर, लिंबू यांची वेगवेगळी चव जाणवतेच. हो ना.
एकदम बरोबर! मिश्रणामध्ये त्याच्या घटक पदार्थांचे गुणधर्म राखले जातात. ते बदलत नाहीत. तसेच सरबताची चव जर आंबट वाटली तर आपण त्यात जास्त साखर घालू शकतो. म्हणजे मिश्रणातील घटक पदार्थांचे प्रमाण आपण बदलू शकतो. ते निश्चित नसते.
ओके! पण मग संयुगासारखे, मिश्रणामध्ये त्याच्या घटक पदार्थांचे गुणधर्म का बदलत नाहीत?
अरे मिश्रणातील घटक पदार्थांचे रेणू एकमेकांशी रासायनिक बंधाने जोडले जात नाहीत. ते भिन्नच राहतात. संयुगामध्ये मात्र ते रासायनिक बंधाने जोडले जातात.
बाबा, मिश्रणामध्ये घटक पदार्थांचे रेणू एकमेकांना रासायनिक बंधाने जोडले जात नाहीत. ते भिन्नभिन्न राहतात म्हणून मिश्रणातील घटक पदार्थ आपल्याला वेगळे करता येतात. म्हणजे बघा ना, आता जर मी हे दूध गाळले तर गाळण्यात बोर्नव्हिटा राहील आणि दूध गाळण्यातून खाली येईल. चहा गाळतानाही असेच होते. कधीकधी आई धान्य पाखडून घेते. पावसाळ्यामध्ये पाणी जर गढूळ आले तर आई ते निवळण्यासाठी ठेवते किंवा उकळून घेते. म्हणजे गाळणे, पाखडणे, निवळणे, उकळणे या विविध पद्धतींनी मिश्रणातील घटक वेगळे करता येतात.
एकदम बरोबर! मिश्रणातील घटक पदार्थांचे भौतिक गुणधर्म भिन्नभिन्न असल्यामुळे या भौतिक पद्धती वापरून मिश्रणातील घटक वेगळे करू शकतो.याशिवाय इतरही काही भौतिक पद्धती वापरता येतात. जसे उर्ध्वपातन(Distillation), विलगकारी नरसाळे(Separating funnel) वापरून, क्रोमॅटोग्राफीचा वापर करून
याशिवाय स्फटिकीभवन (Crystallization), संप्लवन (Sublimation), अपकेंद्री (Centrifugation), अवक्षेप तयार करून, मिश्रणातील घटक पदार्थ वेगळे करता येतात.
बापरे! खूपच वेगवेगळ्या भौतिक पद्धतीने मिश्रणातील घटक पदार्थ वेगळे करता येतात. मी नक्की पद्धतींची माहिती मिळविन. बाबा, तुम्ही म्हणालात की, तुमचे सरबत हे समांगी मिश्रण आणि माझे दूध हे विषमांगी मिश्रण. समांगी आणि विषमांगी हे झाले मिश्रणाचे दोन प्रकार. पण समांगी म्हणजे समान आणि विषमांगी म्हणजे विषम अंग असं काहीतरी का?
जवळ जवळ तसेच. जेव्हा मिश्रणाच्या सर्व घटकांची मिळून एकच प्रावस्था(Phase) असते तेव्हा त्या मिश्रणाला समांगी मिश्रण(Homogeneous mixture) म्हणतात. याउलट ज्या मिश्रणात दोन किंवा अधिक प्रावस्था असतात त्याला विषमांगी मिश्रण(Heterogeneous mixture) म्हणतात.
प्रावस्था म्हणजे काय? प्रावस्था आणि अवस्था या दोघांचा अर्थ एकच का?
नाही. या दोघांचा अर्थ एकच नाही. तू मगाशी म्हणालास ना, माझ्या ग्लासमधील सरबत एक सारखे दिसत आहे. पण तुझ्या ग्लासमधील दुधामध्ये तळाशी बोर्नव्हिटा दिसतोय. माझ्या ग्लास मधील सर्व द्रव्याचे भौतिक गुणधर्म व रासायनिक संघटन एकसारखे आहे. म्हणजे सर्व द्रव्याचे संघटन संपूर्ण राशीभर एकसारखे आहे. सर्व घटकांची मिळून एकच प्रावस्था आहे. ते एकजिनसी आहे म्हणून त्याला समांगी मिश्रण असे म्हणतात. पण तुझ्या ग्लास मध्ये तळाशी असलेला बोर्नव्हिटा व त्यावर बोर्नव्हिटा विरघळलेले दूध असे आहे. म्हणजे सर्व द्रव्याचे भौतिक गुणधर्म व रासायनिक संघटन एकसारखे नाही. सर्व घटकांची मिळून एकच प्रावस्था नाही. तर दोन प्रावस्था मिळतात म्हणून त्याला विषमांगी मिश्रण म्हणतात. प्रावस्था म्हणजे द्रव्याचे भौतिक गुणधर्म व रासायनिक संघटन होय. तर अवस्था म्हणजे द्रव्याची स्थिती.
म्हणजे बाबा समजा, मी थोड्याशा पाण्यात थोडीशी साखर विरघळवली तर त्याचं जे द्रावण तयार होईल ते समांगी मिश्रण. पण त्याच पाण्यात खूप साखर घातली इतकी की, ती न विरघळता पाण्याच्या तळाशी बसली तर ते विषमांगी मिश्रण. हवा समांगी मिश्रण आहे. गहू व तांदूळ एकत्र केले तर ते विषमांगी मिश्रण. पाणी आणि तेल एकत्र केलं तर ते विषमांगी मिश्रण बरोबर ना.
अगदी फटाफट उदाहरण सांगितलीस संजू. समांगी मिश्रणलाच 'द्रावण'( Solution) म्हणतात. उदा. मिठाचे पाणी, साखरेचा पाक, हवा, पोलाद, स्टेनलेस स्टील, अल्कोहल व पाणी इत्यादी इत्यादी. द्रावणामध्ये द्रावक आणि द्राव्य असे दोन घटक पदार्थ असतात. द्रावणात जो घटकपदार्थ सर्वाधिक प्रमाणात असतो त्याला द्रावक म्हणतात व द्रावकापेक्षा कमी प्रमाणात असणाऱ्या इतर घटक पदार्थांना द्राव्य म्हणतात. जो पदार्थ विरघळतो त्याला द्राव्य(Solute) म्हणतात. तर द्राव्य ज्यामध्ये विरघळते त्याला द्रावक(Solvent) म्हणतात. द्राव्य द्रावकात मिसळून द्रावण बनण्याची क्रिया म्हणजे विरघळणे. साधारणपणे द्रावण म्हटले की त्यात द्रावक म्हणून पाणी वापरले असते. पाण्यात बरेच पदार्थ विरघळतात म्हणून पाण्याला वैश्विक द्रावक(Universal solvent) म्हणतात.
ओके. साखरेच्या पाकात द्रावक पाणी व साखर द्राव्य. पोलाद यात लोखंड द्रावक व कार्बन द्राव्य. अल्कोहोल व पाणी यात, पाणी हे द्रावक व अल्कोहोल हे द्राव्य. म्हणजे बाबा, या द्रावणांमध्ये पण वेगवेगळे प्रकार दिसतात.
हो संजू, पोलादात लोखंड व कार्बन म्हणजे स्थायू मध्ये स्थायू. मिठाचे पाणी यामध्ये द्रवामध्ये स्थायू. हवा, यामध्ये वायूमध्ये वायू , अल्कोहोल व पाणी यामध्ये द्रवामध्ये द्रव. द्रावणातील घटकांच्या अवस्थांप्रमाणे, द्रावणाचे अनेक प्रकार होतात. त्यातील काही मी तुला आत्ताच सांगितले आहेत. उरलेल्यांचा विचार कर आणि एक तक्ता तयार कर .
येस बॉस! विषमांगी द्रावणांमध्ये जे दोन प्रकार तुम्ही सांगितले, त्याबद्दल सांगा ना.
विषमांगी मिश्रणामध्ये दोन वेगवेगळे प्रकार आढळून येतात.१) निलंबन(Suspension) व २) कलिल (Colloid). हे विषमांगी मिश्रणाचे प्रकार आहेत म्हणजे त्यांच्यामध्ये दोन किंवा अधिक प्रावस्था असतात.
उदाहरणे घेऊन हे प्रकार समजावून देतो म्हणजे कळायला सोपं जाईल. तू मगाशी भरपूर साखर तळाशी राहिलेलं साखरेचे पाणी याचे उदाहरण दिलेस. ते आहे निलंबनाचे उदाहरण. साध्या डोळ्यांनी न विरघळलेली साखर सहज दिसते. गाळण कागदाच्या सहाय्याने हे मिश्रण गाळले तर गाळण कागदावर न विरघळलेली साखर शिल्लक राहील. कोणत्याही रासायनिक अभिक्रियेत जेव्हा अवक्षेप म्हणजे द्रावकात न विरघळणारा स्थायू पदार्थ तयार होतो तेव्हा ते निलंबनाचे उदाहरण असते. या रासायनिक अभिक्रियांबद्दल आपण नंतर बोलूच. कलिलचे नेहमीच्या वापरातले उत्तम उदाहरण म्हणजे दूध. दुधात पाणी, प्रथिने, स्निग्ध पदार्थ, दुग्ध शर्करा व इतर पदार्थांच्या छोट्या छोट्या कणांचे मिश्रण असते. यातील प्रावस्था स्पष्टपणे वेगवेगळ्या दिसत नाहीत. कारण यातील कण अत्यंत छोटे असतात. ते नुसत्या डोळ्यांनी स्पष्टपणे दिसू शकत नाहीत. गाळण कागदाच्या सहाय्याने कलिल गाळले तरी त्यातून हे छोटे कण वेगळे करता येत नाहीत. धूरके, गढूळ पाणी ही झाली कलिलची काही उदाहरणे.
म्हणजे बाबा, निलंबन आणि कलिल यातील मुख्य फरक म्हणजे निलंबनातील भिन्न प्रावस्था असलेले घटक पदार्थ आपल्याला साध्या डोळ्यांनी दिसू शकतात. परंतू, कलिल मध्ये भिन्न प्रावस्था असणारे घटक पदार्थ साध्या डोळ्यांनी दिसू शकत नाहीत. निलंबनातील भिन्न प्रावस्था असलेले कण वेगळे करू शकतो पण कलिल मधील नाही.
अगदी बरोबर. संजू, द्रावणाप्रमाणेच,त्यातील घटक पदार्थांच्या अवस्थांवरून कलिल व निलंबनाचे ही विविध प्रकार पडतात. तेव्हा घटक पदार्थांच्या अवस्थांवरून द्रावण, निलंबन व कलिल यांच्या पडणाऱ्या प्रकारांचा एक तक्ता तयार कर.

तेवढ्यात हातात गरम-गरम चहाचा कप घेऊन आई खोलीत प्रवेश करते. काय झाला की नाही अभ्यास?
आई, किती कडक चहा पितेस ग. वास येतोय त्या चहाचा. अरे, मला कडकच चहा आवडतो. मला नाही आवडत फिका चहा. कडक आणि फिका चहा यामध्ये काय फरक असतो ग आई?
कडक चहा करताना पाण्यामध्ये चहाची पावडर घालून ते जास्त वेळ उकळवतात. त्यामुळे चहाच्या पानांचा अर्क जास्त उतरतो. फिक्या चहामध्ये कमी वेळ उकळवतात त्यामुळे चहाच्या पानांचा अर्क कमी असतो.
संजू विज्ञानात यालाच द्रावणाची संहती असे म्हणतात. कडक चहामध्ये चहाच्या पानांचा अर्क जास्त असतो म्हणजे ते झाले संहत. तर फिक्या चहामध्ये चहाच्या पानांचा अर्क कमी असतो म्हणजे ते झाले विरल.
ओ!असं काय! विज्ञानाच्या पुस्तकात नेहमी संहत आम्ल, विरल आम्ल हे शब्द बऱ्याच वेळेला वापरतात त्याचा अर्थ आता मला कळला.
संहती या शब्दाची शास्त्रीय व्याख्या पण माहिती पाहिजे बर का संजीव. त्याची व्याख्या अशी "द्रावणाच्या एक एकक एवढ्या आकारमानात विरघळलेल्या द्राव्याच्या वस्तुमानाला द्रावणाची संहती(Concentration) म्हणतात." म्हणजे समजा मी दोन भांडी घेतली त्या दोन्ही भांड्यात 100 मिलिलिटर पाणी घेतले. एका भांड्यात 5 ग्रॅम मीठ टाकले दुसऱ्या भांड्यात 10 ग्रॅम मीठ टाकले तर कोणत्या भांड्यातील द्रावणाची संहती जास्त असेल?
बाबा, साहजिकच दुसऱ्या भांड्यातील द्रावणाची संहती जास्त असेल.
बरोबर! संजू, एक शेवटचा महत्वाचा मुद्दा. मगाशी तू भरपूर साखर तळाशी राहिलेल्या साखरेच्या पाण्याचे उदाहरण दिलेस त्या द्रावणाला संपृक्त द्रावण म्हणतात. संपृक्त द्रावण म्हणजे त्या तापमानाला, त्या द्रावणातील द्रावकाची द्राव्य सामावून घेण्याची क्षमता संपलेली असते,त्यामुळे द्राव्य द्रावकात न विरघळता तसेच द्रावणात राहते. "एखाद्या द्रावणात, विशिष्ट तापमानाला, द्रावकाच्या दिलेल्या आकारमानात / वस्तुमानात जेव्हा जास्तीत जास्त द्राव्य विरघळलेले असते तेव्हा त्या द्रावणाला संपृक्त द्रावण(Saturated solution) म्हणतात."
म्हणजे बाबा, जर एखाद्या संपृक्त द्रावणाचे तापमान वाढवले किंवा त्यातील द्रावकाचे आकारमान वाढविले तर त्या द्रावणात आणखीन द्राव्य विरघळेल, त्यामुळे जरी ते द्रावण आधी संपृक्त असले तरी ते आता संपृक्त राहणार नाही. असेच ना!
करेक्ट! या संपृक्त द्रावणापासूनच आपल्याला एखाद्या पदार्थांचे स्फटिक मिळविता येतात. तू सुध्दा साखरेच्या किंवा मिठाच्या संपृक्त द्रावणापासून त्यांचे स्फटिक मिळवू शकतोस. त्यासाठी वेगवेगळ्या पध्द्ती वापरू शकतोस. विचार कर.
बाबा नक्कीच हा प्रयोग मी करीन. खरंच, खूपच मजा येते स्व-अध्ययन करताना.
संजू,या सवयीचा पुढील अभ्यासासाठी, स्पर्धा परीक्षा देताना नक्कीच खूपच उपयोग होईल. बरं चला आता, आईने मस्तपैकी पाव-भाजी केलेली दिसतेय. कधीपासून वास येतोय त्या मिश्रणाचा. चला आस्वाद घ्यायला.
Send us your feedback
All diagrams, pictures, tables etc. are from websites on Internet. We are thankful to all these sources.
Vidnyanvahini is a Non-Governmental Organisation (NGO) and this entire write up is for students, teachers and general public, free of charge.
IT IS NOT FOR ANY COMMERCIAL USE.
