रसायन शास्त्र (Chemistry) 
9 September 2020
द्रव्याचे स्वरूप (भाग 1)
28 October 2020
द्रव्याचे स्वरूप (भाग 2)
4 November 2020
अणू संरचना (भाग - 1)
25 December 2020
अणू संरचना (भाग - 2)
8 January 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 1)
28 April 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 2)
13 May 2021
धातू व अधातू
5 September 2021
धातू व अधातूचे रासायनिक गुणधर्म
19 September 2021
आपण धातू व अधातूंचे भौतिक गुणधर्म बघितले. आता आपण रासायनिक गुणधर्म बघूया. धातू इलेक्ट्रॉन देणारे असतात. धातूंची इलेक्ट्रॉन गमावण्याची किंवा देण्याची क्षमता जेवढी अधिक, तेवढा धातूगुण अधिक. अति क्रियाशील धातूपासून अक्रियाशील धातूपर्यंत धातूंच्या क्रियाशीलतेत तफावत आढळते क्रियाशीलते प्रमाणे धातूंची क्रमवारी लावली आहे. त्याला धातूंची क्रियाशीलता श्रेणी म्हणतात.
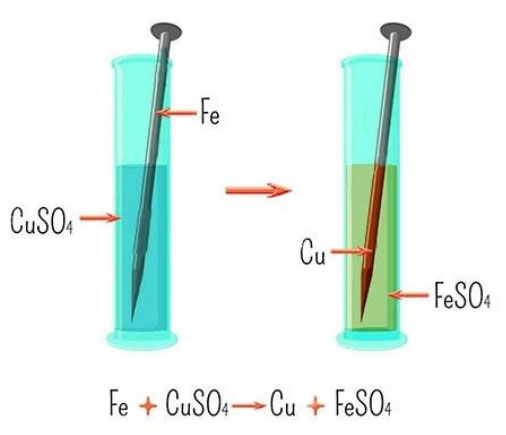
धातूंची क्रियाशीलता श्रेणी : वैज्ञानिकांनी धातूंची क्रियाशीलता श्रेणी तयार केली आहे. कशी बरं काढली असेल ही श्रेणी? एक सोपा प्रयोग आपणही करून बघु शकतो. मोरचूदाचे (CuSO4) पाणी घालून द्रावण तयार करा. त्यात स्वच्छ न गंजलेल्या लोखंडी खिळा घाला. थोड्याच वेळात खिळ्यावर लाल रंगाचा थर बसलेला दिसेल. द्रावणाच्या निळ्या रंगातही बदल झालेला दिसेल. खिळ्यावर जमा झालेला लाल थर म्हणजे CuSO4 च्या द्रावणातील Cu आहे आणि द्रावणात हळूहळू Cu ची जागा Fe ने घेऊन Fe SO4 तयार होते. काय अभिक्रिया झाली?
CuSO4 + Fe → FeSO4 + Cu
ही विस्थापन अभिक्रिया झाली. हो ना? आता FeSO4 च्या द्रावणात Cu ची तार घाला. त्यावर Fe जमा होत नाही. म्हणजे Fe हे Cu पेक्षा जास्त क्रियाशील आहे. असा निष्कर्ष आपण काढू शकतो. अशा अनेक विस्थापन अभिक्रियांचा अभ्यास करून ही क्रियाशीलता श्रेणी तयार केली आहे. अधातूंचीही क्रियाशीलता श्रेणी आहे. खाली दिलेली क्रियाशीलता श्रेणी ही आपल्या नेहमीच्या माहितीतील धातू पुरती मर्यादित आहे. पूर्ण श्रेणी इंटरनेटवर उपलब्ध आहे.
धातूंची क्रियाशीलता श्रेणी
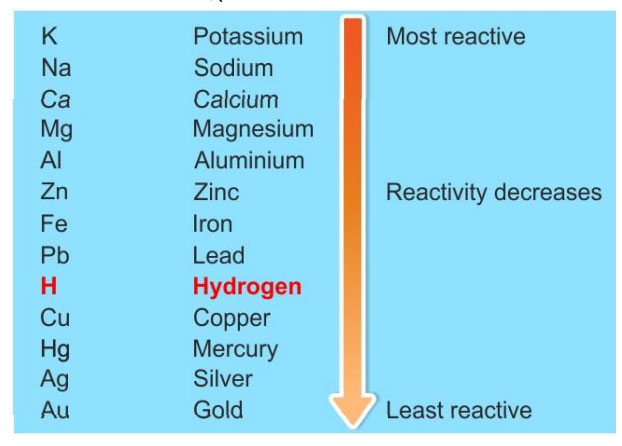
अधातूंची क्रियाशीलता श्रेणी
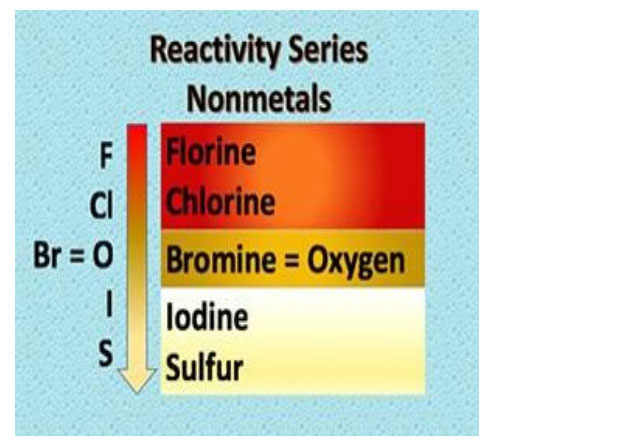
धातूंच्या क्रियाशीलता श्रेणीत हायड्रोजन कसा काय आला असा प्रश्न पडला का? हा तुलनेसाठी आहे.
हा एक अतिशय उपयुक्त तक्ता आहे. यावरून आपल्याला अभिक्रिया होईल की नाही याचा अंदाज सांगता येतो.
- धातूंची पाण्याबरोबर अभिक्रिया – सोडियम, पोटॅशियम यांची पाण्याबरोबर तात्काळ व तीव्र अभिक्रिया होते व हायड्रोजन बाहेर पडतो.

2 Na(s) + 2 H2O(L) → 2 NaOH(aq) + H2↑(g) + उष्णता
कॅल्शियमची अभिक्रिया त्या मानाने मंदगतीने होते. हायड्रोजन बाहेर पडतो. त्याचे बुडबुडे जमा झाल्याने धातू पाण्यावर तरंगतो. पोहायला शिकताना हवा भरलेले टायर वापरतो तसंच या बुडबुड्यांमुळे धातू तरंगतो.
2 Ca(S) + 2 H2O(L) → 2 Ca(OH)2(aq) + H2(g) ↑
क्रियाशीलता श्रेणीत कॅल्शियमच्या खाली मॅग्नेशियम आहे. मॅग्नेशियम चा तुकडा पाण्यात टाकला तर मंद अभिक्रिया होते किंवा टेस्ट ट्यूब थोडी गरम करावी लागते.
त्याच्या खाली असलेले अॅल्युमिनियम जस्त वगैरेची पाण्याच्या वाफेबरोबर अभिक्रिया होते. कमी क्रियाशील धातूंची होईल का? नाही होणार. बरोबर ना?
अधातुंची पाण्याबरोबर अभिक्रिया - सर्वसाधारणपणे अधातूंची पाण्याबरोबर अभिक्रिया होत नाही. अपवाद हॅलोजनचा
Cl(g) + H2O(L) → HOCl(aq) + HCl(aq)
- धातूंची ऑक्सिजनबरोबर अभिक्रिया - धातूंची ऑक्सिजनबरोबर अभिक्रिया होते व ऑक्साईड बनते. मॅग्नेशियमची फीत हवेत तापवली तर मॅग्नेशियम ऑक्साईड मिळते. हे ऑक्साइड पाण्यात घातले तर अभिक्रिया होते. मॅग्नेशियम हायड्रॉक्साइड मिळते.

2 Mg(s) + O2 → 2MgO(s)
MgO + H2O → Mg(OH)2
धातूंची ऑक्साइड आम्लारी धर्मी असतात.
अधातूंची ऑक्सिजनबरोबर अभिक्रिया - अधातूंची ऑक्सिजनबरोबर अभिक्रिया होते. सामान्यतः ही ऑक्साइड आम्लधर्मी असतात. काही बाबतीत उदासीन ऑक्साइड बनते. कार्बनचे पूर्ण ज्वलन झाले तर आम्लधर्मी ऑक्साइड बनते.
C + O2 → CO2 (आम्लधर्मी)
कार्बनचे अपूर्ण ज्वलन झाले तर उदासीन ऑक्साइड बनते.
2C + O2 → 2CO (उदासीन)
सल्फरचे ज्वलन केले तर आम्लधर्मी SO2 तयार होते.
S + O2 → SO2 (आम्लधर्मी)
- धातूंची आम्ला बरोबर अभिक्रिया - धातूंची आम्लाबरोबर अभिक्रिया झाली तर धातूंचा क्षार तयार होतो व हायड्रोजन मुक्त होतो.
HCl बरोबर अभिक्रिया झाली तर त्या धातूचे क्लोराईड बनते. H2SO4 बरोबर सल्फेट बनते.
उदा. Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
अशी अभिक्रिया Cu बरोबर होत नाही. अभिक्रियाशीलता श्रेणी वरुनही आपण हे सांगू शकतो. Cu वर नायट्रिक आम्लाची अभिक्रिया होते पण यात हायड्रोजन बाहेर पडत नाही तर NO2 किंवा NO हे वायू बाहेर पडतात.

Cu(s) + HNO3(aq) → Cu(NO3)2(aq) + 2NO2(g) + 2 H2O(L)
संहत
3CuS + 8HNO3(aq) → 3Cu(NO3)2(aq) + 2NO(g) + 4H2O(L)
विरल
सोन्यासारख्या अक्रियाशील धातूला विरघळण्यासाठी तेजाबसारखे जहाल आम्ल लागते. संहत हायड्रोक्लोरिक आम्ल व संहत नायट्रिक आम्ल 3:1 या प्रमाणात घेऊन ते बनवले जाते. त्याला आम्लराज म्हणतात.
अधातूंवर आम्लाची अभिक्रिया - अधातूंवर विरल आम्लाची अभिक्रिया होत नाही. अपवाद हॅलोजनचा. इथे आपल्याला अधातूंची क्रियाशीलता श्रेणी उपयोगी पडते. क्लोरीन हा ब्रोमिन पेक्षा क्रियाशील आहे. हायड्रोब्रोमिक आम्ल (HBr) आणि क्लोरीन यात विस्थापन अभिक्रिया होते.
Cl2(g) + 2HBr(aq) → 2HCl(aq) + Br2(aq)
- धातू व अधातूंची अभिक्रिया - धातू इलेक्ट्रॉन देणारे असतात, अधातू इलेक्ट्रॉन घेणारे किंवा भागीत (Sharing) वापरणारे असतात. अधातूंमधील हॅलोजन आणि धातू यामध्ये इलेक्ट्रॉनची देवाणघेवाण होऊन धातूचा क्षार बनतो. नेहमी वापरले जाणारे सोपे उदाहरण सोडियम आणि क्लोरिनचे. 2Na + Cl2 → 2NaCl
असा इलेक्ट्रॉन पुरता देऊन टाकल्याने धातूचा धनभारित आयन बनतो आणि इलेक्ट्रॉन घेतल्याने अधातूंचा ऋणभारित आयन बनतो. अशा बनलेल्या संयुगाला आयनिक संयुग म्हणतात. आयनिक संयुगांची वैशिष्टये
- स्फटिकरूप असतात.
- मजबूत आयनिक बंध. त्यामुळे द्रवणांक व उत्कलनांक उच्च असतात.
- विद्युतदृष्टया उदासीन असतात.
- पाण्यात विरघळतात. या द्रावणामधून विद्युत प्रवाह वाहतो. धनभारित आयन ऋण अग्राकडे व ऋण भारीत आयन धन अग्राकडे आकर्षिला जातो. वितळलेल्या अवस्थेतही विद्युत प्रवाह वाहू शकतो म्हणून आयनिक संयुगांना विद्युत अपघटनी पदार्थ म्हटले जाते. CuCl2 चे पाण्यात द्रावण केले आणि त्यातून विद्युत प्रवाह जाऊ दिला तर ऋणाग्रावर Cu व धनाग्रावर Cl2 मिळतो. शुध्द धातू मिळवण्यासाठी याचा उपयोग होऊ शकतो
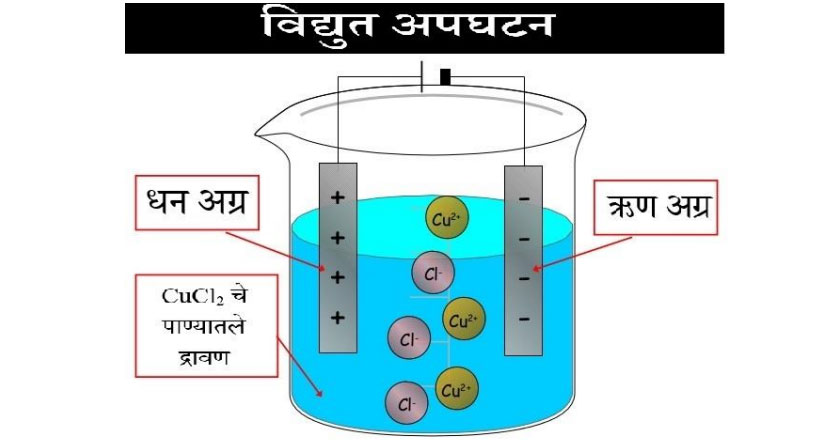

सोने प्लॅटिनम हे धातू शुध्द रूपात मिळतात. पण बाकीचे धातू हे संयुगाच्या रूपात मिळतात. धातूंची संयुगे माती वाळू सारख्या अशुध्दींबरोबर बरोबर निसर्गात मिळतात त्याला खनिजे असे म्हणतात. ज्या खनिजांपासून सोयीस्करपणे व फायदेशीररीत्या धातू मिळवता येतो त्याला धातूके म्हणतात. धातूपासून शुध्द धातू मिळविण्यासाठी या रासायनिक व भौतिक गुणधर्माचा उपयोग होतो. धातुशास्त्र (Metallurgy) हे एक महत्त्वाचे तंत्रज्ञान आहे. प्राचीन काळापासून भारतात धातुशास्त्र वापरले जाते. त्याची उदाहरणे आपल्याला आजही मिळतात. दिल्लीला कुतुबमिनार जवळ उभा असलेला विजयस्तंभ हे त्याचेच एक उदाहरण आहे. हा स्तंभ अनेक शतके न गंजता उन्हापावसात उभा आहे. याचे कारण असे की आपल्याच पूर्वजांनी तो संमिश्रापासून तयार केला आहे. त्या लोहामध्ये अत्यल्प प्रमाणात कार्बन, सिलीकॉन व फॉस्फरस मिसळले आहे.

लोखंड गंजते, तसेच चांदीच्या वस्तू हवेतील H2S मुळे काळवंडतात, तांब्याची भांडी हिरवट होतात ती हवेतील CO2 व दमटपणामुळे CuCO3 तयार झाल्यामुळे. अमेरिकेतील न्यूयॉर्क शहराजवळ समुद्रात स्वातंत्र्यदेवतेचा पुतळा आहे मूळ पुतळ्याचा पृष्ठभाग हा तांब्यापासून बनवलेला आहे. पण आता तो हिरव्या रंगाचा दिसायला लागला आहे. याचं कारण हवेतील कार्बन डाय ऑक्साइड व आर्द्रतेचा अभिक्रिया तांब्या बरोबर होऊन हिरव्या रंगाचा कॉपर कार्बोनेटचा थर त्यावर तयार झाला आहे.
हे सर्व टाळण्यासाठी अनेक उपाय केले जातात. हवेशी संपर्क येऊ न देणे या उद्देशाने दुसऱ्या पदार्थाचा लेप दिला जातो.
|
1 |
रंग देणे (Painting) |
लोखंडावर रंग दिला जातो काही काळानंतर रंग उडून जातो पुन्हा रंग द्यावा लागतो. |
||
|
2 |
जस्ताचे विलेपन (Galvanizing) |
लोखंडावर जस्ताचा पातळ थर देणे. जस्ताचे क्षरण आधी होते. थर असतो तोपर्यंत लोखंडाचे गंजण्यापासून रक्षण होते. |
||
|
3 |
कथीलीकरण (Tinning) |
वितळलेल्या कथिलाच्या थर देण्यात येतो. यालाच कल्हई करणे असे आपण म्हणतो. हेही पुनःपुन्हा करावे लागते. |
||
|
4 |
धनाग्रीकरण (Anodization) |
तांबे, ॲल्युमिनियम यावर त्यांच्या ऑक्साइडचा पातळ पण मजबूत थर विद्युत अपघटनाद्वारे देतात. |
||
|
5 |
विद्युत विलेपन (Electroplating) |
विद्युत अपघटनाद्वारे कमी अभिक्रियाशील धातूचा थर दिला जातो. |
||
|
6 |
संमिश्रीकरण |
एका धातूमध्ये ठरावीक प्रमाणात दुसरा धातू वा अधातू मिसळून एकजिनसी मिश्रण केले जाते. |
||
|
1 |
ब्राँझ |
90% तांबे + 10% कथील |
||
|
2 |
स्टेनलेस स्टील |
74% लोह + 18% क्रोमियम + 8% कार्बन |
||
|
3 |
पितळ |
66% तांबे + 34% जस्त |
||
|
4 |
एक धातू पारा असेल तर Amalgam म्हटले जाते |
|||
आतापर्यंत आपण धातू व अधातूंच्या भौतिक व रासायनिक गुणधर्मांची माहिती घेतली. रोज वापरत असलेल्या धातू व अधातूंचा उपयोग आपण त्यांच्या गुणधर्मानुसार करतच असतो. पण आपले स्मार्टफोन अधिकाधिक स्मार्ट करण्यातही त्यांचा महत्त्वाचा वाटा आहे .

काळाच्या ओघात संपत आलेला कल्हई उद्योग
Send us your feedback
All diagrams, pictures, tables etc. are from websites on Internet. We are thankful to all these sources.
Vidnyanvahini is a Non-Governmental Organisation (NGO) and this entire write up is for students, teachers and general public, free of charge.
IT IS NOT FOR ANY COMMERCIAL USE.
