रसायन शास्त्र (Chemistry) 
9 September 2020
द्रव्याचे स्वरूप (भाग 1)
28 October 2020
द्रव्याचे स्वरूप (भाग 2)
4 November 2020
अणू संरचना (भाग - 1)
25 December 2020
अणू संरचना (भाग - 2)
8 January 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 1)
28 April 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 2)
13 May 2021
धातू व अधातू
5 September 2021
धातू व अधातूचे रासायनिक गुणधर्म
19 September 2021

वेगवेगळ्या मूलद्रव्यांचा शोध लागत गेला तसे त्यांचे वर्गीकरण करणे आवश्यक बनले. अगदी पहिल्या वर्गीकरणामध्ये मूलद्रव्यांची विभागणी धातू आणि अधातू अशी केली गेली. अजूनही हे वर्गीकरण आवर्तसारणीत ठळकपणे दिसते. 92 नैसर्गिक मूलद्रव्यांमध्ये 70 मूलद्रव्ये धातूंची आहेत.
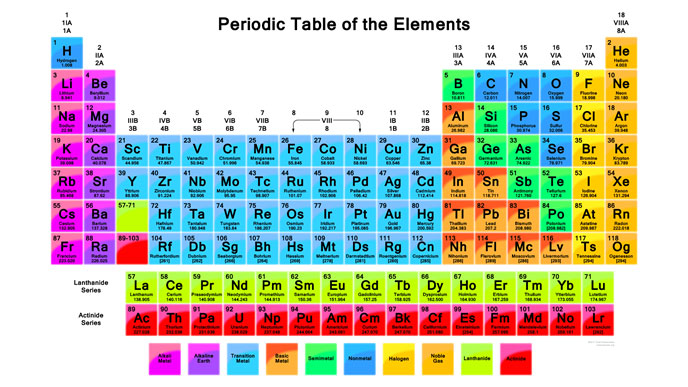
या आवर्तसारणीत वेगवेगळे रंग उपगट दाखवायला वापरले आहेत. धातूंमध्ये ही उपगट आहेत आणि अधातूंमध्येही आहेत. पण धातू सगळे डावीकडे आणि अधातू उजवीकडे आणि दोन्हीच्या मध्ये धातूसदृश मूलद्रव्यांचा छोटा गट आहे. आवर्तसारणीत डावीकडून उजवीकडे जाताना अणुक्रमांक वाढत जातो आणि इलेक्ट्रॉनच्या रचनेवर गुणधर्म अवलंबून असतात हे लक्षात घेऊ या. धातू व अधातू अशी विभागणी गुणधर्मांवर आधारलेली आहे. हा फरक कशामुळे येतो? धातूंचे विशिष्ट गुणधर्म धातूबंधामुळे येतात. काय असतो हा धातूबंध?
धातूबंध (Metallic Bond) - धातूंमध्ये अणूंची विशिष्ट रचना असते. आवर्तसारणी नीट बघितली तर आपल्या असं लक्षात येईल की धातूंचा अणूंच्या बाह्य कक्षेतील इलेक्ट्रॉनची संख्या जास्तीत जास्त तीन आहे. पहिल्या गणात बाह्य कक्षेत 1 इलेक्ट्रॉन दुसऱ्या गणात 2 व तेराव्या गणात 3 इलेक्ट्रॉन आहेत. उदा. Na 2,8,1 Mg 2,8,2 Al 2,8,3 पण मग मधल्या संक्रामक गटाचे काय? असा प्रश्न पडला असेल. तिथे इलेक्ट्रॉन्स वाढत जातात पण ते d या आंतर कक्षेत. बाह्य कक्षा त्या आवर्तनातील s ही कक्षाच आहे. धातूंमध्ये हे बाह्य कक्षेतील इलेक्ट्रॉन एका अणूशी निबद्ध न राहता अलग होतात मुक्त किंवा स्वतंत्र (Free, delocalized) होतात आणि मुक्तपणे त्रिमिती जालकात फिरत राहतात. उदाहरण सांगायचं झालं तर, तुम्ही शाळेच्या पटांगणात खेळत असता तेव्हा शाळेच्या बाहेर गेलेले नसता. शाळेत असता, पण वर्गात नसता. तसंच म्हणता येईल. इलेक्ट्रॉन जालकात फिरत असतात पण एका अणूशी बांधलेले रहात नाहीत. अशा सर्व अणूंच्या मुक्त इलेक्ट्रॉनचा जणू ढगच तयार होतो म्हणाना! का बरं मुक्त होतात हे इलेक्ट्रॉन? बाह्य कक्षा केंद्रकापासून थोडी दूर असल्याने केंद्रकाचे त्यावरील आकर्षण बल थोडे दुर्बल होते. त्यामुळे हे बाह्य कक्षेतील इलेक्ट्रॉन मुक्त होतात. आता इलेक्ट्रॉन बाहेर पडला म्हणजे अणूवर काय परिणाम होईल? त्यावर धनभार येईल बरोबर ना? म्हणजे धातूमध्ये धनभार असलेला अणू व मुक्त इलेक्ट्रॉनचा ढग असे त्रिमिती जालकात असतात. हे त्रिमिती जालक काय आहे? धातू एखाद्या महारेणू सारखा असतो. अणूंचा एकमेकांवर स्तर बनतो आणि त्रिमिती रचना बनते. मुक्त इलेक्ट्रॉन यात फिरत राहतात.
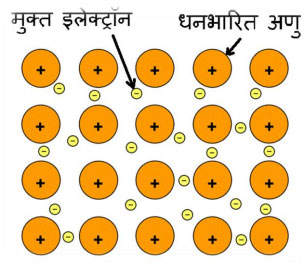
धनभारित अणू व मुक्त इलेक्ट्रॉन यात इलेक्ट्रोस्टॅटिक आकर्षण बल निर्माण होते त्यामुळे ते विशिष्ट रचनेत राहतात. या आकर्षण बलाला धातूबंध म्हणतात. हा एक रासायनिक बंध आहे.
एक प्रश्न निर्माण झाला का? अणु धनभारित होतो तरी संज्ञा लिहिताना आपण ते दाखवत का नाही? म्हणजे Na लिहितो Na+ का नाही? इलेक्ट्रॉन अणूशी निबद्ध नाही पण त्या जाळ्यातच आहे, पुरता गमावून टाकलेला नाही. हो ना? म्हणून संज्ञा भाररहीतच दाखवली जाते.
अधातुंमध्ये इलेक्ट्रॉन मुक्त का होत नाहीत? अधातू आवर्तसारणीत उजवीकडे आहेत. म्हणजे अणुक्रमांक वाढत गेला आहे. बाह्य कक्षेतील इलेक्ट्रॉनची संख्या वाढत जाते. तसे केंद्रकात प्रोटॉनची संख्याही वाढत जाते. म्हणजे केंद्रकाचे आकर्षण बलही वाढते. त्यामुळे अणूचा आकार कमी होत जातो. बाह्य कक्षेवरही बल राहते. त्यामुळे इलेक्ट्रॉन निबद्ध राहतात. तुम्ही रस्सीखेच खेळता की नाही? खेचणारे वाढले की काय होते तुम्हाला माहिती असेलच!
धातूबंध, मुक्त इलेक्ट्रॉनचा पृष्ठभागाशी ढग आणि धनभारित अणू या पायावर आपण धातू व अधातुंचे गुणधर्म बघुया.
- चमक (Lustre) धातूंच्या पृष्ठभागावरील मुक्त इलेक्ट्रॉन प्रकाश किरण परावर्तित करतात म्हणून धातू चमकदार असतात. हवेतील घटकांचा परिणाम होऊन ते काळवंडतात. मात्र सोन्यावर हवा, पाण्याचा परिणाम होत नाही म्हणून सोन्याची चमक कायम राहते.
अधातू - अधातूंना चकाकी नाही. - अवस्था (State) - धातू स्थायू अवस्थेत असतात. उच्च तापमानाला ते वितळतात. अपवाद पाऱ्याचा. कक्ष तापमानापेक्षाही कमी तापमानाला (Melting Point -38.830C) पारा वितळतो. त्यामुळे पारा द्रवरुपात असतो. सीसियम व गॅलियम या दोन धातूंचा द्रवणांकही फारच कमी असतो.
अधातू - स्थायू, द्रव व वायू या तीनही अवस्थेत आढळतात.
- कठीणपणा (Hardness) - धातूबंधामुळे धातू कठीण असतात. सहजपणे तुटत नाहीत. धातुबंध जितका जोमदार तितका तो धातू कठीण असतो. मग सोडियम पोटॅशियम मऊ कसे असा प्रश्न पडणे स्वाभाविक आहे. त्यातील धातूबंध कमी जोमदार (Weak) असतो म्हणून.
अधातू - अधातूंमध्ये धातूबंध नसल्याने ते ठिसूळ असतात. पुन्हा अपवाद हिरा. हिरा हा अतिशय कठीण असतो. त्यातील कार्बनचे अणू अतिशय सुनिबद्ध बंधानी जोडलेले असतात. त्यांची परस्पर सापेक्ष हालचाल होत नाही. म्हणून हिरा अतिशय कठीण.
- तन्यता व वर्धनीयता - धातूंमध्ये एकमेकांवर अणुचे स्तर तयार होतात. बाहेरील बलामुळे ते घसरू शकतात. त्यामुळे धातूची तार काढता येते, पत्राही ठोकता येतो. बाहेरील बलांमुळे इलेक्ट्रॉनच्या ढगांचा आकार बदलू शकतो आणि बदललेल्या आकारात धन आयन आपली रचना बदलतात. सोन्याची अतिशय बारीक तार व पातळ पत्रा बनवता येतो.
अधातू - अधातू ठिसूळ असल्यामुळे हे संभवत नाही. - वीज व उष्णतावाहकता (Conduction of heat and electricity) - सर्व धातू विजेचे सुवाहक आहेत. आपण जेव्हा धातूला वीज पुरवतो म्हणजेच इलेक्ट्रॉन्सचा पुरवठा करतो तेव्हा हे इलेक्ट्रॉन धातूंमधील मुक्त इलेक्ट्रॉनला पुढे ढकलतात. अशा रीतीने इलेक्ट्रॉन वाहू लागतात. म्हणजेच मुक्त इलेक्ट्रॉन मुळे वीज वहन होते. धातूला उष्णता पुरवतो तेव्हाही ऊर्जेमुळे अणु कंप पावतात. हे कंपन त्या धातुभर पसरते. अणु मुक्त इलेक्ट्रॉन्समुळेही उष्णतेचे वहन होते.
अधातू - अधातूंमध्ये मुक्त इलेक्ट्रॉन नसल्यामुळे वीजवहन होत नाही. अपवाद ग्रॅफाईट या कार्बनच्या अपरूपाचा. ग्रॅफाईट विजेचा सुवाहक आहे. म्हणजे त्यात मुक्त इलेक्ट्रॉन असणार. अंदाज बरोबर आहे. ग्रॅफाइटचा स्थायू स्तरांनी बनलेला असतो. विशिष्ट रचनेमुळे निबद्ध नसलेले इलेक्ट्रॉन असतात. त्यामुळे ग्रॅफाईट सुवाहक आहे. - नादमय (Sonorous) - धातूंवर आघात केला असता नाद उत्पन्न होतो. चांदी नादमय आहे. पितळ आणि ब्राँझ हे मिश्रधातूही नादमय आहेत. म्हणून घंटा, झांजा नेहमी या धातूंच्या असतात. आपण जेव्हा धातूवर आघात करतो तेव्हा मुक्त इलेक्ट्रॉनचा ढग सहज कंप पावतो. या उर्जेचे रुपांतर ध्वनी लहरीत होते. धातू लवचिक (Elastic) असल्यामुळे या लहरी वेगाने पसरतात. त्यामुळे नाद उत्पन्न होतो. सर्व धातू नादमय नाहीत. असं का असेल? जास्त घनतेच्या धातूंमध्ये गतीज उर्जा (Kinetic Energy) सहजपणे पसरत नाही. त्यामुळे असे धातू नादमय नसतात.
अधातुंमधील स्थायू लवचिक नसतात. त्यामुळे ते नादमय नसतात.
धातूंच्या मूलद्रव्यात बाह्य कक्षेतील इलेक्ट्रॉन मुक्त होतात पण गमावले जात नाहीत. मात्र रासायनिक अभिक्रियेत इलेक्ट्रॉन पुरता दिला जातो आणि धातूचा विद्युत धन आयन बनतो म्हणून धातूंच्या मूलद्रव्याला विद्युत धन मूलद्रव्ये असे म्हटले जाते. आपण रासायनिक गुणधर्म पुढील भागात बघूया.
Send us your feedback
All diagrams, pictures, tables etc. are from websites on Internet. We are thankful to all these sources.
Vidnyanvahini is a Non-Governmental Organisation (NGO) and this entire write up is for students, teachers and general public, free of charge.
IT IS NOT FOR ANY COMMERCIAL USE.
