रसायन शास्त्र (Chemistry) 
9 September 2020
द्रव्याचे स्वरूप (भाग 1)
28 October 2020
द्रव्याचे स्वरूप (भाग 2)
4 November 2020
अणू संरचना (भाग - 1)
25 December 2020
अणू संरचना (भाग - 2)
8 January 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 1)
28 April 2021
मूलद्रव्यांची आवर्तसारणी (भाग - 2)
13 May 2021
धातू व अधातू
5 September 2021
धातू व अधातूचे रासायनिक गुणधर्म
19 September 2021
आधीच्या भागात आपण बघितले की आता मूलद्रव्यांची मांडणी त्याचा अणुअंक आधारभूत धरून केली आहे. त्यामुळे ती अणूच्या इलेक्ट्रॉन संरुपणावर सुद्धा आधारलेली आहे.
सर्व 118 मूलद्रव्यांचे संरूपण लिहिल्यावर मूलद्रव्यांतील अणूंचे अणुअंक, इलेक्ट्रॉन संरूपण व रासायनिक गुणधर्म यांचा विचार करून पुढील मांडणी तयार होते. हीच ‘मूलद्रव्यांची आधुनिक आवर्तसारणी’.
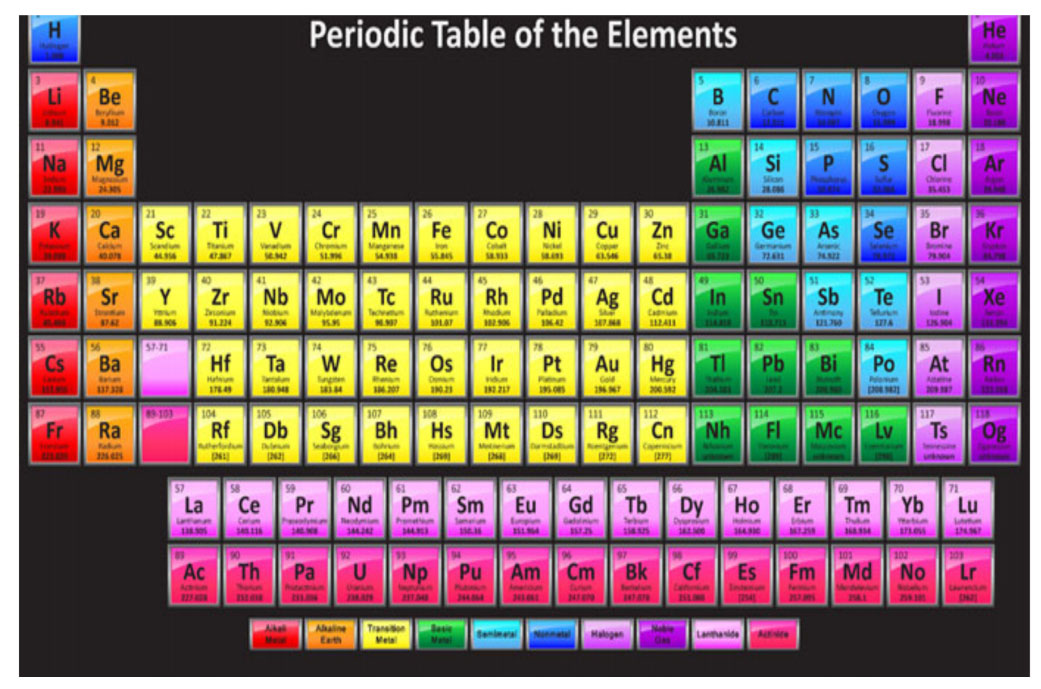
या आवर्तसारणीचे नीट निरीक्षण करून काही महत्वाच्या मुद्याची नोंद करूया. काय दिसते या आवर्तसारणीत?
1) सगळ्यात पहिल्यांदा लक्षात येतात ते वेगवेगळे रंग. या रंगाबद्दल आपण नंतर माहिती करून घेणार आहोत.
2) आवर्तसारणीतील रकाने - गण.
आवर्तसारणीत उभे रकाने दिसत आहेत. किती आहेत? मोजा बरं 1,2,3,---------18. बरोबर एकूण 18 रकाने आहेत. त्यांना ‘गण’ असे म्हणतात. म्हणजेच आवर्तसारणीत 18 गण आहेत.
तुमच्या लक्षात आले का?
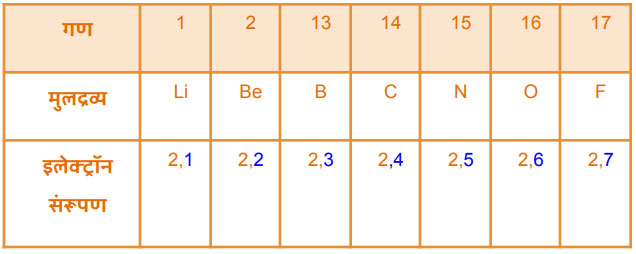
प्रत्येक गणातील मूलद्रव्यांच्या अणूंचे बाहय इलेक्ट्रॉन संरुपण व त्यामुळे रासायानिक गुणधर्म सारखे आहेत. तसेच वरून खाली जाताना अणुअंकात वाढ झाली आहे.
यातील काही गणांना विशिष्ट नांवे दिली आहेत.
गण - 1 : अल्कली धातू (या गणातील मूलद्रव्यांची पाण्याबरोबर अभिक्रिया होऊन अल्कली तयार होतात.)
गण - 2 : अल्कधर्मी मृदा धातू. (या गणातील मूलद्रव्ये सुद्धा पाण्याबरोबर अल्कली तयार करतात. शिवाय ती खनिज स्वरूपात सापडतात.)
गण - 17 : हॅलोजन्स.
गण - 18 : राजवायू.
3) आवर्तसारणीतील आडव्या ओळी - आवर्त :
आवर्तसारणीच्या मुख्य भागात काही आडव्या ओळी दिसतात किती आहेत त्या? 7 ना? बरोबर. शिवाय मुख्य भागाखाली 14 -14 मूलद्रव्यांच्या दोन ओळी सुद्धा आहेत. पण त्यांचे स्थान 3 ऱ्या गणात व 6 व्या आणि 7 व्या आवर्तात दाखविले आहे हे लक्षात आले का?या आडव्या ओळींना ‘आवर्त’ म्हणतात. कारण प्रत्येक नवीन ओळ सुरु होताना नवीन ऊर्जास्तर/ कक्षा भरायला सुरुवात होते व त्यामुळे मूलद्रव्यांच्या गुणधर्मांचे नवीन आवर्तन सुरु होते.
म्हणजेच आवर्तसारणीत 7 आवर्त आहेत. प्रत्येक आवर्तात असणाऱ्या मूलद्रव्यांची संख्या मोजा बरं !
या आवर्तांना नांवे दिली आहेत.
आवर्त - 1 : अतिलघु आवर्त (2 मूलद्रव्ये)
आवर्त - 2,3 : लघु आवर्त (8,8 मूलद्रव्ये)
आवर्त - 4,5 : दीर्घ आवर्त (18,18 मूलद्रव्ये)
आवर्त - 6,7 : अतिदीर्घ आवर्त (32,32 मूलद्रव्ये)
हे रकाने व आवर्त यांच्या रचनेमुळे आवर्तसारणीत चौकटी तयार झालेल्या दिसतात. प्रत्येक चौकटीत एकएक मूलद्रव्य आहे. मूलद्रव्याचा अणुअंक हाच त्यांचा क्रमांक आहे. म्हणजे पहिल्या आवर्तात डावीकडून मोजणी सुरु केली तर क्रमाने अणुअंकानुसार ऊर्जास्तरात मांडली आहेत. याचाच अर्थ 15 व्या चौकटीत असणाऱ्या मूलद्रव्याचा अणुअंक 15 आहे.
4) इलेक्ट्रॉन संरुपणानुसार विभागणी - खंडमूलद्रव्यांच्या अणूंमधील बाहय स्तरातील इलेक्ट्रॉनच्या स्थानानुसार आवर्तसारणीची विभागणी करता येईल का? विचार करा. बाहय स्तरातील इलेक्ट्रॉन s, p, d किंवा f ह्या उपस्तरात आहेत. हे इलेक्ट्रॉन संरुपणावरून लक्षात आलेच आहे. तसेच प्रत्येक गणतील मूलद्रव्यांच्या अणूंचे बाह्य इलेक्ट्रॉन संरुपण एकसारखे आहे. त्यामुळे आवर्त सारणीचे 4 भाग (खंड,block) झालेले दिसतात. हया चार खंडांचे आवर्तसारणीतील स्थान सांगता येईल का? बघा बरं. ती आकृती अशी दिसेल:
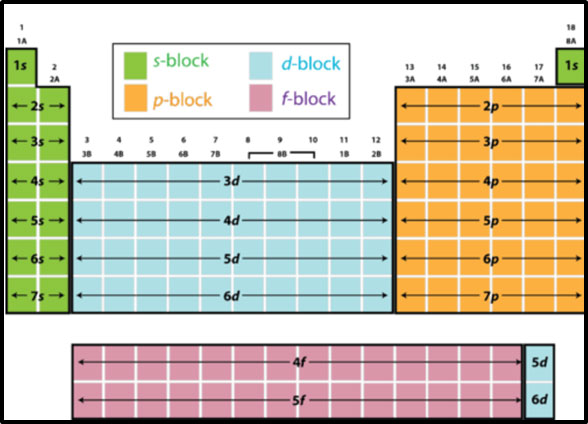
s खंड - आवर्त सारणीत डाव्या बाजूला. गण - 1, 2. आवर्त - 1 ते 7.
(s या उपऊर्जास्तरात जास्तीतजास्त 2 इलेक्ट्रॉन राहू शकतात.)
p खंड - आवर्तसारणीत उजव्या बाजूला. गण - 13 ते 18. आवर्त - 1 ते 7.
(p या उपऊर्जास्तरात जास्तीतजास्त 6 इलेक्ट्रॉन्स राहू शकतात.)
d खंड - आवर्तसारणीत s आणि p खंडाच्यामध्ये. गण - 3 ते 12. आवर्त - 4 ते 7.
(d या उपऊर्जास्तरात जास्तीतजास्त 10 इलेक्ट्रॉन्स राहू शकतात.)
f खंड - मुख्य आवर्तसारणीच्या खाली 2 ओळीत. गण - 3. आवर्त - 6,7.
(f या उपऊर्जास्तरात जास्तीतजास्त 14 इलेक्ट्रॉन्स राहू शकतात.)
या खंडांमधील मूलद्रव्यांना काही नांवे दिली आहेत. ती नांवे बघूया.
s आणि p खंड - सामान्य मूलद्रव्ये.
या मूलद्रव्यांमध्ये फक्त बाहेरील ऊर्जास्तर अपूर्ण असतो. राजवायू च्या मूलद्रव्यांबरोबर बाह्य कक्षेतील इलेक्ट्रॉनचे अष्टक पुरे होते. (अपवाद हेलियम)
d - खंड - संक्रामक मूलद्रव्ये.
या मूलद्रव्यांमध्ये बाह्य व त्याच्या आधीचा एक असे दोन ऊर्जास्तर अपूर्ण असतात.
f - खंड - आंतर संक्रामक मूलद्रव्ये.
या मूलद्रव्यांमध्ये बाह्य व त्याच्या आधीचे दोन असे तीन ऊर्जास्तर अपूर्ण असतात.
मूलद्रव्यांच्या गुणधर्मांचा आवर्तीकल
मूलद्रव्यांचे भौतिक व रासायनिक गुणधर्म हे अणुअंकावर म्हणजेच पर्यायाने इलेक्ट्रॉन संरुपणावर अवलंबून असतात. अणुअंक जसा वाढत जाईल त्याप्रमाणे त्यात बदल (वाढ किंवा घट) दिसून येतात. एक ऊर्जास्तर भरला की पुढील ऊर्जास्तर भरण्यास सुरुवात होते व गुणधर्माचे नवीन आवर्तन सुरु होते. हे गुणधर्म कसे बदलतात ते आता आपण समजून घेणार आहोत. या गुणधर्माच्या बदलालाच गुणधर्माचे ‘आवर्तीकल’ असे म्हणतात. हे आवर्तीकल समजून घेण्यासाठी वेगवेगळे गुणधर्म कोणत्या गोष्टींवर अवलंबून आहेत ते माहीत असणे आवश्यक आहे.
ज्या गुणधर्मांमध्ये आवर्तीकल दिसून येतात त्यापैकी काही गुणधर्म पुढील प्रमाणे:
1. अणुआकारमान.
2. संयुजा.
3. धातू गुण.
4. रासायनिक क्रियाशीलता.
हे बदल आवर्तामध्ये व गणांमध्ये कसे होतात ते बघू या.
1. अणू आकारमान
अणूंचे आकारमान ठरवताना अणू हा गोलाकार आहे असे समजले जाते. त्यामुळे त्याचे आकारमान अणुत्रिज्येवर अवलंबून असते. (गोलाचे आकारमान=4πत्रिज्या3/3) अणुत्रिज्या म्हणजे केंद्रक व बाह्यतम ऊर्जा स्तरातील इलेक्ट्रॉन यामधील अंतर.
ही अणुत्रिज्या/अणूंचे आकारमान वेगवेगळ्या मूलद्रव्यांच्या अणूंमध्ये आवर्तात व गणात कसे बदलते ते आता बघूया.
(अ) सामान्य मूलद्रव्ये
आवर्तातील बदल: एखाद्या आवर्तात डावीकडून उजवीकडे जाताना अणुअंक वाढतो तसेच इलेक्ट्रॉन ची संख्या सुद्धा वाढते. नवीन येणारा इलेक्ट्रॉन त्याच उर्जास्त्तरात (कक्षेत) प्रवेश करतो. केंद्रकातील धन प्रभार वाढल्यामुळे इलेक्ट्रॉन्स वरील आकर्षण बल वाढत जाते. त्यामुळे इलेक्ट्रॉन्स थोडेसे केंद्रकाकडे ओढले जातात. यामुळे एका आवर्तात अणुअंक वाढेल तसे अणुचे आकारमान कमी होते. उदा.
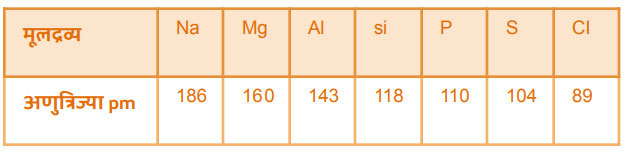
गणातील बदल: एखाद्या गणात वरून खाली जाताना अणुअंक वाढलेला असतो त्याच बरोबर इलेक्ट्रॉनची संख्या सुद्धा वाढते. इलेक्ट्रॉन पुढल्या ऊर्जास्तरात प्रवेश करतात. त्यामुळे अणुत्रिज्या व आकारमान वाढते. उदा:
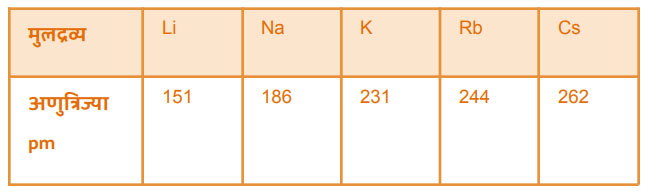
(ब) राजवायू : गणामध्ये वरून खाली जाताना इलेक्ट्रॉन्स नवीन कक्षेत प्रवेश करतात. त्यामुळे मूलद्रव्यांमधील अणुत्रिज्या/अणूचे आकारमान वाढते.
(क) संक्रामक मूलद्रव्ये :
आवर्तातील बदल : एका आवर्तात डावीकडून उजवीकडे जाताना अणुअंक व इलेक्ट्रॉन ची संख्या वाढते. हे नवीन इलेक्ट्रॉन बाह्य ऊर्जास्तरात न जाता आतील ऊर्जास्तरात भरले जातात. (4थ्या आवर्तात 3d ऊर्जास्तरात, 5व्या आवर्तात 4d ऊर्जास्तरात). त्यामुळे बाह्य इलेक्ट्रॉनचे केंद्रका पासूनचे अंतर फारसे बदलत नाही. म्हणून संक्रामक मूलद्रव्यांमध्ये मूलद्रव्यांमधील अणूंचे आकारमान साधारण सारखेच असते.
गणातील बदल : वरून खाली जाताना नवीन इलेक्ट्रॉन पुढील उर्जास्त्ररात भरला गेल्यामुळे अणुत्रिज्या/ अणूंचे आकारमान वाढते.
(ड) आंतर संक्रामक मूलद्रव्ये :
आवर्तातील बदल : डावीकडून उजवीकडे जाताना अणुअंक वाढेल तशी इलेक्ट्रॉनची संख्या वाढते. हे इलेक्ट्रॉन्स f उर्जास्तरात जातात. या ऊर्जा स्तराची इलेक्ट्रॉन सामावून घेण्याची क्षमता 14 इलेक्ट्रॉन्स एवढी आहे. त्यामुळे हे इलेक्ट्रॉन्स जरी आतील ऊर्जास्तरात भरले गेले तरी अणुअंक वाढेल तशी केंद्रकातील वाढत्या धन प्रभारामुळे अणुत्रिज्येमधे थोडी घट होते. यालाच 'लॅंथनाईडचे आकुंचन' म्हणतात. (lanthanide contraction). कारण या मूलद्रव्यांपैकी पहिल्या श्रेणीतील पहिले मूलद्रव्य आहे लॅंथेनियम्. दुसऱ्या श्रेणीमध्ये सुद्धा ॲक्टीनियम आकुंचन दिसते.
गणातील बदल: या दोन श्रेणी आहेत. लॅंथनाईड श्रेणी मधील य मूलद्रव्यांच्या आकारमानाच्या तुलनेत ॲक्टिनाइड श्रेणी मधील मूलद्रव्यांचे आकारमान जास्त असण्याऐवजी कमीच असते. त्याला कारण म्हणजे या श्रेणी मधील मूलद्रव्यांच्या अणूंमध्ये इलेक्ट्रॉन्स 5f या उर्जास्तरात प्रवेश करतात त्यामुळे ते विखुरलेले असतात.शिवाय या मूलद्रव्यांचे अणुअंक व अणुवस्तुमानांक दोन्ही जास्तच असते. त्यामुळे इलेक्ट्रॉन्स थोडेसे केंद्रकाकडे खेचले जातात. त्याचा परिणाम म्हणून अणूच्या आकारमानात घट होते.
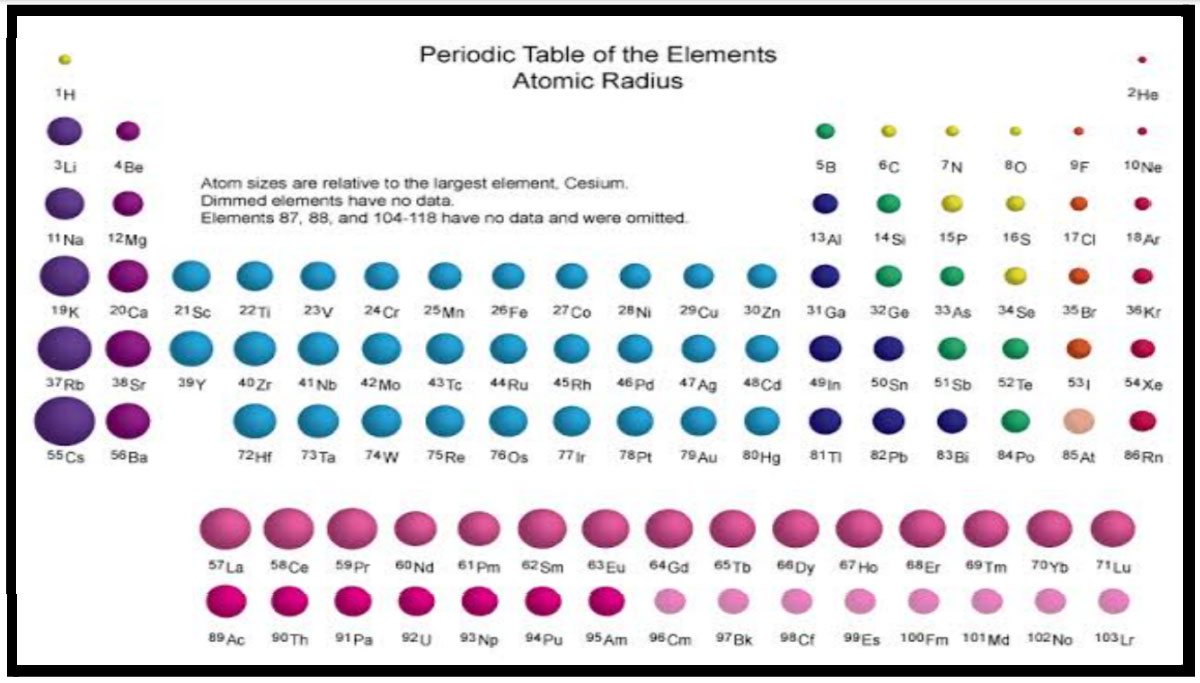
या सर्वांचा एकत्र विचार केला असता वेगवेगळ्या मूलद्रव्यांच्या अणूंच्या आकारमानात कसा बदल होतो ते खालील आकृती वरून स्पष्ट होईल.
एखाद्या मूलद्रव्याची संयुजा त्या मूलद्रव्याच्या अणुमधील बाह्य उर्जास्तरातील इलेक्ट्रॉनच्या संख्येवर अवलंबून असते हे तुम्हाला माहित आहे. म्हणूनच या इलेक्ट्रॉनना 'संयुजा इलेक्ट्रॉन' म्हणतात. तुम्हाला हे पण माहीत आहे की अणूंच्या बाह्य कक्षेत 1/2/3 इलेक्ट्रॉन्स असतील तर तो अणू संयुगे तयार करताना 1/2/3 इलेक्ट्रॉन्स देऊन स्थिर ऊर्जास्थिती (आधीच्या राजवायू च्या अणू प्रमाणे इलेक्ट्रॉन संरूपण) प्राप्त करून घेतो व धन आयन तयार होतो. जेवढे इलेक्ट्रॉन्स दिले जातील तेवढा धन प्रभार आयना वर येतो. त्याउलट जर 5/6/7 असे इलेक्ट्रॉन्स बाह्यकक्षेत असतील तर 3/2/1 इलेक्ट्रॉन घेऊन ऋण आयन तयार होतो. यावेळेस पुढील राजवायुच्या अणू प्रमाणे इलेक्ट्रॉन संरूपण तयार होते. जेवढे इलेक्ट्रॉन्स घेतले जातील तेवढा ऋणप्रभार त्याच्या आयनावर येतो. या धन व ॠण प्रभारानुसार त्या मूलद्रव्याची संयुजा ठरते. (इथे आपण फक्त आयनिक संयुगांचा विचार करत आहोत.)
(अ)सामान्य मूलद्रव्ये
आवर्तातील बदल : डावीकडून उजवीकडे जाताना अणुअंक व त्याबरोबरच संयुज इलेक्ट्रॉनच्या संख्येत वाढ होते. उदा: दुसरे आवर्त
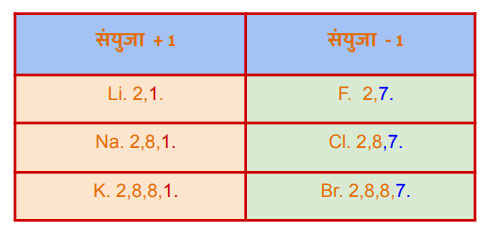
गणक्रमांक 1, 2 व 13 यातील मूलद्रव्यांच्या अणूंमध्ये बाह्य ऊर्जास्तरात 1, 2, 3 असे इलेक्ट्रॉन्स आहेत. इलेक्ट्रॉन्स देऊन त्या मूलद्रव्यामध्ये मूलद्रव्यांमध्ये +1, +2, +3 अशा संयुजा दिसतात. त्यानुसार त्या मूलद्रव्यांच्या संयुगांची रासायनिक सूत्रे पुढीलप्रमाणे लिहिली जातात. LiCl, BeCl2, BF3 तर 15, 16, 17 या गणातील मूलद्रव्यांच्या अणूंमध्ये अनुक्रमे 5, 6, 7 इलेक्ट्रॉन्स आहेत. म्हणजे या मूलद्रव्यांमध्ये -3, -2 ,-1 अशा संयुजा दिसतात. या संयुजा लक्षात घेऊन लिथियम या धातूचे नाईट्राइड, ऑक्साईड व क्लोराईड ची रेणूसुत्रे लिहिता येतील का?
वरील उदाहरणांवरून असे लक्षात येईल की डावीकडून उजवीकडे जाताना आवर्तामध्ये धन संयुजेमध्ये वाढ होते तर ऋण संयुजेमध्ये घट होते.
गणातील बदल : एका गणात वरून खाली जाताना बाह्य इलेक्ट्रॉन संरूपण सारखेच असते. त्यामुळे गणातील मूलद्रव्यांच्या संयुजांमधे बदल होत नाही.
(ब) राजवायू : मूलद्रव्यांच्या बाह्य ऊर्जास्तरात 8 इलेक्ट्रॉन्स असतात. त्यामुळे मूलद्रव्यांचे अणू इलेक्ट्रॉन्स देत किंवा घेत नाहीत व त्यांची संयुगे नसतात. म्हणजेच राजवायूंची संयुजा शून्य (0) असते .
(क) संक्रामक मूलद्रव्ये :
आवर्तातील बदल: उजवीकडे जाताना अणुअंक वाढेल तसा नवीन इलेक्ट्रॉन आतील ऊर्जास्तरात प्रवेश करतो. बाह्य ऊर्जास्तरात दोन इलेक्ट्रॉन्स असतात. हा ऊर्जास्तर व आतील ऊर्जास्तर (उदा.4थ्या आवर्तात 4s व 3d) यात ऊर्जेच्या दृष्टीने फारसा फरक नसतो. त्यामुळे बाह्य उर्जास्तरातील 2 इलेक्ट्रॉन्स बरोबर d ऊर्जास्तरातील किती इलेक्ट्रॉन्स संयुगे तयार होताना भाग घेतात त्यावर या मूलद्रव्यांची संयुजा ठरते. त्यामुळे या मूलद्रव्यांमधे ‘परिवर्ती संयुजा’ (variable valency) दिसतात.
उदा. Cu+1, Cu+2, Fe+2, Fe+3 परंतु या संयुजा नेहमी धन संयुजा असतात.
(ड) आंतर संक्रामक मूलद्रव्ये :
या मूलद्रव्यांच्या अणुंमध्ये इलेक्ट्रॉन्स f या आणखीन आतल्या उर्जास्तरात भरले जातात. त्यामुळे संक्रामक मूलद्रव्यांप्रमाणेच या मूलद्रव्यांमध्ये सुद्धा परिवर्ती संयुजा आढळतात. परंतु +3 ही संयुजा प्राधान्याने आढळते. यामुळेच या मूलद्रव्यांना तिसऱ्या गणात स्थान दिले आहे.
3. धातू गुण
मूलद्रव्याचा धातुगुण, मूलद्रव्याच्या अणूमधील बाह्यस्तरातील इलेक्ट्रॉन जितक्या सहजपणे विलग होईल व त्या मूलद्रव्याचा धन आयन जितका सहजपणे तयार होईल त्यावर अवलंबून असतो. हा इलेक्ट्रॉन विलग करण्यासाठी लागणारी ऊर्जा म्हणजे 'आयननऊर्जा. (ionisation energy). ही ऊर्जा जितकी कमी तेवढा धन आयन सहज तयार होतो व मूलद्रव्यात धातुगुण वाढतो.
(अ) सामान्य मूलद्रव्ये :
आवर्तातील बदल: अणू संरुपणानुसार एखाद्या आवर्तात डावीकडून उजवीकडे जाताना क्रमाने अणुक्रमांक व बाह्य ऊर्जा स्तरातील इलेक्ट्रॉनची संख्या वाढत जाते हे आपण बघितलेच आहे. या बाह्य इलेक्ट्रॉन्सवर केंद्रकातील वाढत्या धनप्रभारामुळे अधिक आकर्षण बल कार्य करते. त्यामुळे तो इलेक्ट्रॉन विलग करणे अधिकाधिक कठीण होते. म्हणजेच डावीकडून उजवीकडे जाताना आयऩनउर्जा वाढत जाते. त्यामुळे धातुगुण कमी कमी होत जातो. याचाच अर्थ आवर्तात सुरुवातीची मूलद्रव्ये धातू असतात तर क्रमाने अधातू गुण वाढून नंतरच्या गणातील मूलद्रव्ये अधातू असतात.
उदा: तिसऱ्या आवर्तात
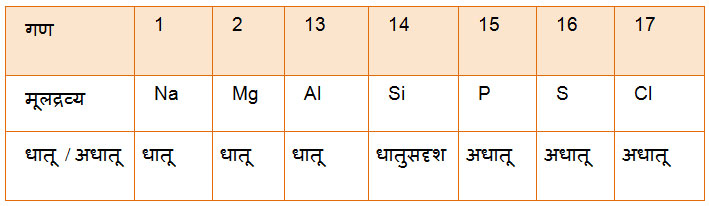
गणामधील बदल: एखाद्या गणात वरून खाली जाताना इलेक्ट्रॉन नवीन ऊर्जास्तरात प्रवेश करतो. अणुत्रिज्या वाढते व बाह्य इलेक्ट्रॉन विलग करणे सुलभ असते. त्यामुळे गणामध्ये वरून खाली जाताना धातुगुण वाढतो. हा बदल अधातूमध्ये जास्त प्रकर्षाने दिसून येतो.
17 व्या गणात हा बदल मूलद्रव्यांच्या भौतिक स्थितीत सुद्धा दिसतो.
उदा: F - वायू, Cl - वायू, Br - द्रव. I - स्थायू. (धातू प्रमाणे चमक)
धातू व अधातू मधील सीमारेषा.
सामान्य मूलद्रव्यांमध्ये, आवर्तात व गणात धातू गुण कशा तऱ्हेने बदलतात ते आपण बघितले आहे. याचा परिणाम p खंडातील मूलद्रव्यांमध्ये कसा होईल? तिसऱ्या आवर्ताचे उदाहरण घेऊया. आवर्तात सुरुवातीच्या गणातील मूलद्रव्य (13 वा गण, Al) धातू गुण दाखवतो व त्यानंतर अधातू गुण वाढत जातो. तसेच गणात वरून खाली जाताना धातू गुण वाढत जातो. त्यामुळे चौदाव्या गणा नंतर आवर्त क्रमांक जसा वाढेल तसा (वरुन खाली जाताना) धातू गुण वाढत जाईल. बरोबर ना? याचा परिणाम म्हणून धातू व अधातू यांना वेगळे करणारी रेषा खंडाच्या कर्ण रेषेवर येईल. अर्थातच या रेषेवर असणाऱ्या मूलद्रव्यांमधे घातू व अधातू असे दोन्ही गुणधर्म दिसतात. त्यांना ‘धातुसदृश मूलद्रव्ये’ म्हणतात. या रेषेच्या डावीकडे धातू व उजवीकडे अधातू आहेत हे लक्षात आले का?
लेखाच्या सुरवातीला आपण असे नमूद केले आहे की आवर्तसारणीतील मूलद्रव्यांना वेगवेगळ्या रंगांची पार्श्वभूमी दिसत आहे. त्यात धातू, अधातू व वेगवेगळे खंड दाखवण्यासाठी वेगवेगळे रंग वापरले आहेत. धातू व अधातू यांच्यातील सीमारेषा सुद्धा स्पष्टपणे दाखवली आहे. आणखी कोणते गुणधर्म वेगळ्या रंगात दाखवले आहेत ? ते शोधा बरं!
(ब) राजवायू : या मूलद्रव्यांच्या अणुंमध्ये बाहेरच्या कक्षेत आठ इलेक्ट्रॉन्स असतात. त्यांची आयनन ऊर्जा खूप जास्त असते. म्हणजेच ही मूलद्रव्ये अधातू आहेत.
(क)संक्रामक मूलद्रव्ये:
आवर्तातील बदल : एका आवर्तात डावीकडून उजवीकडे जाताना इलेक्ट्रॉन आतल्या ऊर्जास्तरात भरला जातो. त्यामुळे बाहेरच्या ऊर्जास्तरातील (s उपउर्जास्तरातील) इलेक्ट्रॉन्स सहज विलग करता येतात व ह्या मूलद्रव्यांचे धन आयन सहजपणे तयार होतात. म्हणजेच ही सर्व मूलद्रव्ये धातू आहेत.
(ड) आंतरसंक्रामक मूलद्रव्ये : संक्रामक मूलद्रव्यांप्रमाणेच या मूलद्रव्यांच्या अणूंमध्ये बाहेरील व काही आतील ऊर्जा स्तरातील इलेक्ट्रॉन्स गमावून धन आयन सहज तयार होतात. त्यामुळे ही सर्व मूलद्रव्ये धातू आहेत.
4. रासायनिक क्रियाशीलता
एखाद्या मूलद्रव्याचा अणू किती सहजपणे धन आयन वा ऋण आयन तयार करतो त्यावर त्या मूलद्रव्याची रासायनिक क्रियांमधील क्रियाशीलता अवलंबून असते. ज्या मूलद्रव्यांमधे धन आयन वा ऋण आयन सहजपणे तयार होतात ते धातू वा अधातू जास्त क्रियाशील असतात.
(1) सामान्य मूलद्रव्ये :
आवर्तातील बदल : एखाद्या आवर्तात डावीकडून उजवीकडे जाताना मूलद्रव्यांमधील आयनन ऊर्जा वाढते. म्हणजेच धन आयन तयार होण्यासाठी जास्त ऊर्जा लागते त्यामुळे सुरुवातीच्या गणामधील धातूंमध्ये क्रियाशीलता क्रमाने कमी होते.
उदा. पहिल्या गणातील सोडियम धातु सामान्य तापमानाला पाण्याबरोबर वेगाने अभिक्रिया करतो. दुसऱ्या गणातील मॅग्नेशियमला याच क्रियेला बराच वेळ लागतो तर तेराव्या गणातील ॲल्युमिनियम वर हीच क्रिया सामान्य तापमानाला फारच संथपणे होते.
त्यापुढील गणांमध्ये अधातूंमधे 17 व्या गणातील अधातू सर्वात जास्त क्रियाशील असतात.
थोडक्यात आवर्तात क्रियाशीलता आधी कमी होते व नंतर त्यात वाढ होते.
गणातील बदल: एखाद्या गणात वरून खाली जाताना आयनन ऊर्जा कमी होते त्यामुळे 1, 2, 13 गणांमधील धातू अधिकाधिक क्रियाशील होतात.
उदा. तिसऱ्या अवर्तातील दुसऱ्या गणातील मॅग्नेशियम पेक्षा चौथ्या आवर्तातील दुसऱ्या गणातील कॅल्शियम हा धातू अधिक क्रियाशील आहे. कॅल्शियमची पाण्याबरोबरची अभिक्रिया अधिक तीव्रतेने होते. तर अधातुमध्ये वरून खाली जाताना ऋण आयन तितक्या सहजपणे तयार होत नाहीत . त्यामुळे आधीच्या आवर्तातील अधातू जास्त क्रियाशील असतात.
उदा. सर्वात क्रियाशील अधातू F.
(ब) राजवायू : ही सर्व मूलद्रव्ये निष्क्रिय आहेत.
(क) संक्रामक मूलद्रव्ये
धातू गुणाचा अभ्यास करताना असे लक्षात आले की सर्व संक्रामक मूलद्रव्ये धातू आहेत. त्यांचे आवर्तसारणीतील स्थान s व p या खंडांच्या मध्ये आहे. धातुंची क्रियाशीलता डावीकडून उजवीकडे कमी होत जाते. याचाच अर्थ संक्रामक मूलद्रव्ये कमी क्रियाशील धातू आहेत. ह़ी कमी झालेली क्रियाशीलता सोने, चांदी, तांबे यासारख्या मूलद्रव्यांमध्ये प्रकर्षाने दिसते. या धातुंवर पाणी, आम्ल, आम्लारी यासारख्या अभिकारकांचा फारसा परिणाम होत नाही.
(ड) आंतर संक्रामक मूलद्रव्ये: ही मूलद्रव्येसुद्धा कमी क्रियाशील धातू आहेत. परंतु त्यांचे आवर्तसारणीतील स्थान लक्षात घेता, हे धातू s खंडातील धातुंपेक्षा कमी तर d खंडातील धातुंपेक्षा अधिक क्रियाशील आहेत.
या सर्व आवर्ती कलांचा एकत्रित विचार केला तर ही आवर्तीफले कशी बदलतात ते पुढील आकृतीवरून लक्षात येईल.
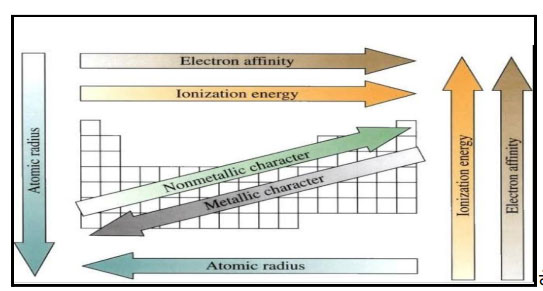
वरील आकृती वरून असे लक्षात येईल की वेगवेगळ्या गुणधर्मांमधील बदलातील संक्रमण d खंडातील मूलद्रव्यांमधून होते. त्यामुळेच या मूलद्रव्यांना संक्रामक मूलद्रव्ये म्हणतात.
मूलद्रव्यांच्या गुणधर्मातील आवर्ती कल समजून घेतले की आवर्तसारणी चा उपयोग दोन प्रकारे करता येतो.
१. मूलद्रव्याचा गण क्रमांक व आवर्त क्रमांक माहित असेल तर त्याच्या गुणधर्मांचा अंदाज लावता येतो.
२. त्या उलट मूलद्रव्याचे गुणधर्म माहीत असतील तर त्याचे आवर्तसारणीतील स्थान साधारणपणे निश्चित करता येते.
वेगवेगळ्या खंडातील मूलद्रव्यांची वैशिष्ट्ये
S खंड
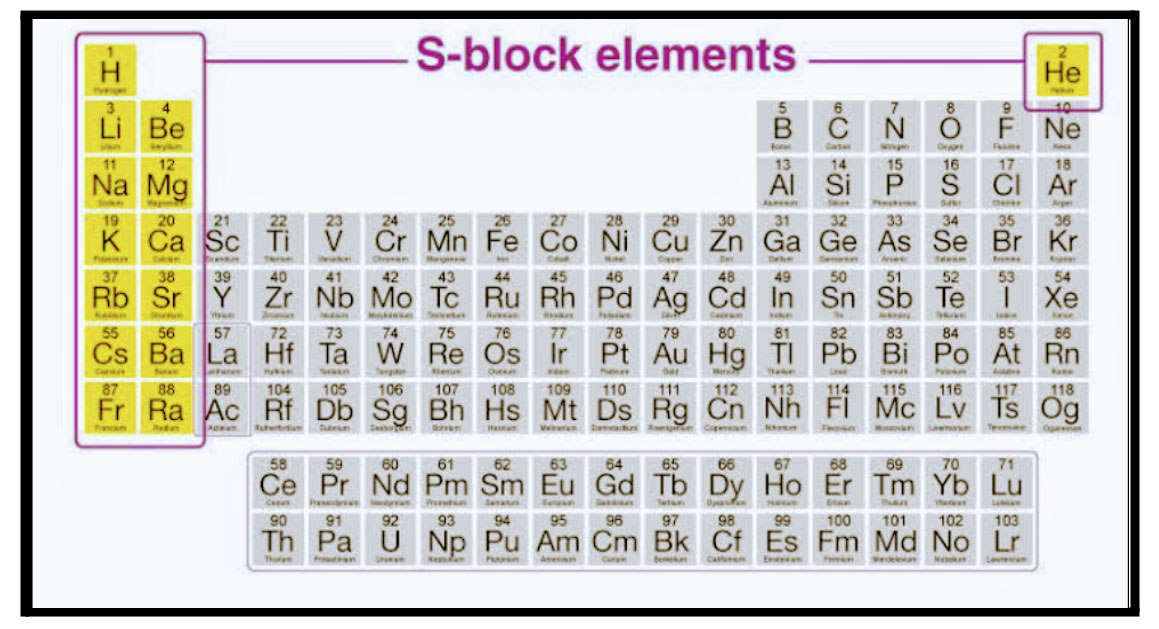
- आवर्तसारणीतील स्थान :
1) गण - 1 व 2.
2)आवर्त -1 ते 7.
3)आवर्तसारणीत डावीकडे. - क्रियाशील धातू (H सोडून). पाणी, आम्ल व आम्लारी याबरोबर अभिक्रिया.
- स्थिर संयुजा : गण 1 : +1 , गण 2 : +2.
- कमी वजन व मोठे आकारमान त्यामुळे कमी घनता
- संयुगे रंगहीन
उदा. NaCl , KNO3
, KNO3  , CaCO3
, CaCO3
- सहजपणे इलेक्ट्रॉन देऊ शकतात त्यामुळे चांगले क्षपणक.
P खंड
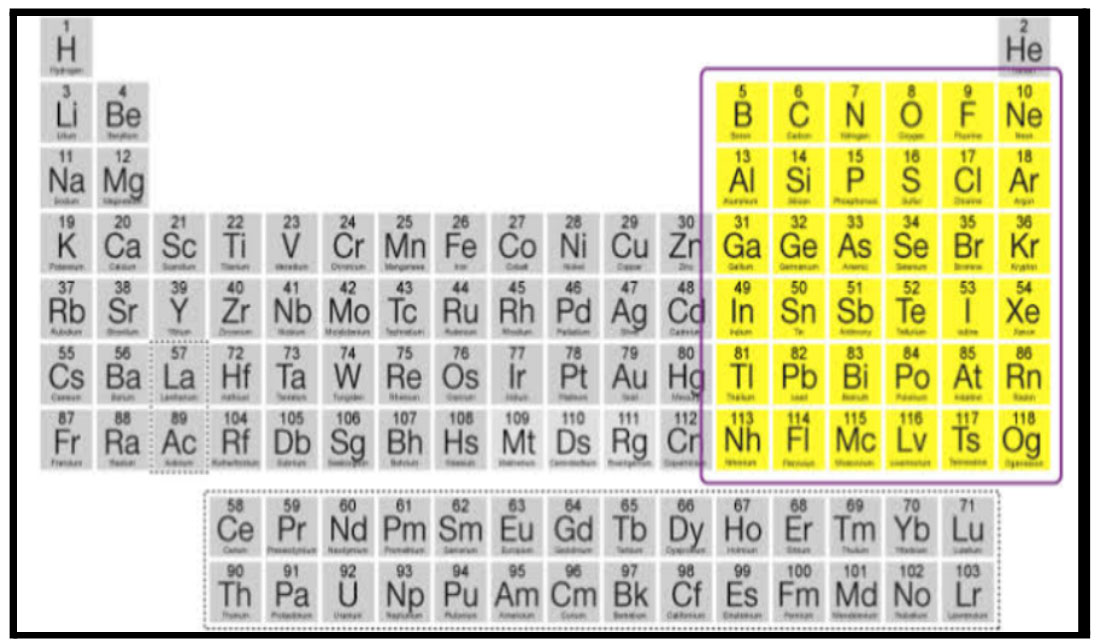
आवर्तसारणीतील स्थान :
1) गण- 13; ते 18
2) आवर्त - 1 ते 7
3) आवर्तसारणीत उजवीकडे.
- सर्व प्रकारच्या मूलद्रव्यांचा समावेश - धातू, अधातू, धातुसदृश्य.धातू कमी क्रियाशील तर अधातू क्रियाशील.
- राजवायू निष्क्रिय.
- संयुगे रंगहीन उदा. NaCl, KNO3, CaCO3
- या खंडातील मूलद्रव्य आपापसात संयुगे तयार करू शकतात. याची उदाहरणे देता येतील का?
- मूलद्रव्यांमध्ये तिन्ही प्रकारच्या भौतिक स्थिती आढळून येतात. प्रत्येक स्थितीतील मूलद्रव्याचे एक एक उदाहरण शोधा.
- अधातू सहजतेने इलेक्ट्रॉन घेऊ शकतात. त्यामुळे चांगले ऑक्सिडीकारक.
d खंड
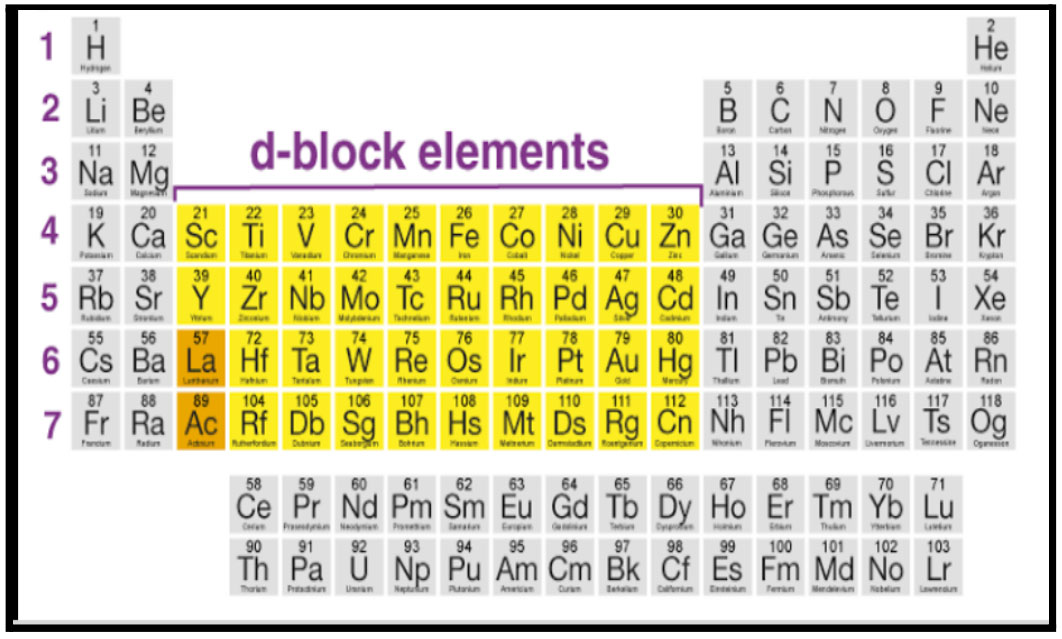
आवर्तसारणीतील स्थान:
- गण - 3 ते 12.
- आवर्त - 4 ते 7.
- s आणि p खंडाच्या मध्ये.
- सर्व मूलद्रव्ये कमी क्रियाशील धातू.
- परीवर्ती संयुजा.
- रंगीत संयुगे उदा.
CuSO4 - निळे , Co(NO3)2- लाल
, Co(NO3)2- लाल  ,
,
NiCl2 - हिरवा , KMnO4 - जांभळा
, KMnO4 - जांभळा 
- काही मूलद्रव्ये चुंबकीय गुणधर्म दाखवतात. उदा : Fe, Co, Ni
f खंड
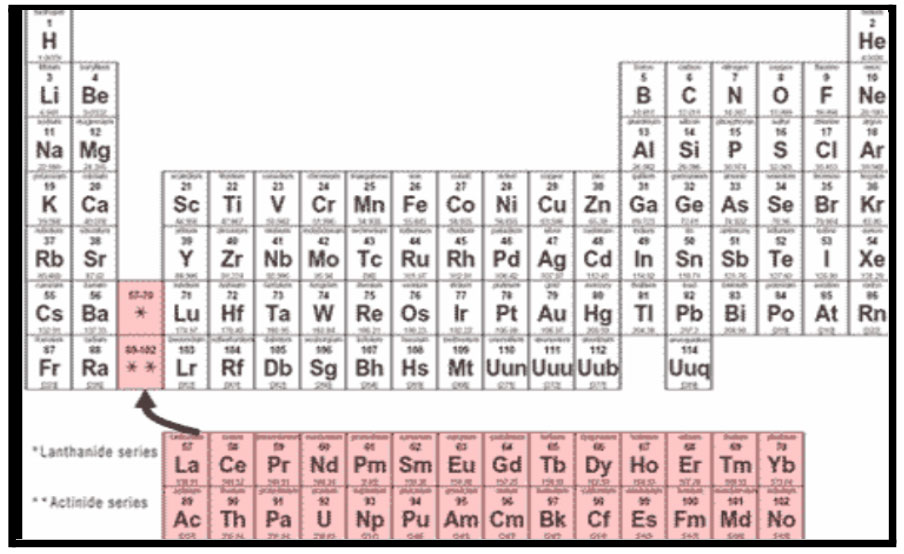
आवर्तसारणीतील स्थान :
- गण - 3.
- 2.आवर्त - 6 व 7.
- आवर्तसारणीतील 7 व्या आवर्ताखाली स्वतंत्र 2 ओळी.
- सर्व मूलद्रव्ये धातू. s खंडातील मूलद्रव्यांपेक्षा कमी क्रियाशील.
- तर d खंडातील मूलद्रव्यांपेक्षा जास्त क्रियाशील.
- परिवर्ती संयुजा. +3 संयुजा जास्त संयुगांमधे आढळते.
- संयुगे रंगीत. संयुजेनुसार रंग बदलतो.
आत्तापर्यंत आपण वेगवेगळ्या खंडांमधील मूलद्रव्यांची माहिती करून घेतली. या मूलद्रव्यांचे गुणधर्म आवर्तात व गणात कसे बदलतात हेही समजून घेतले. आपल्याला माहिती आहे की आवर्तसारणीत एकूण 118 मूलद्रव्ये आहेत. त्यामधील काही मूलद्रव्ये त्यांच्यातील काही वैशिष्ट्यांमुळे उठून दिसतात. अशा वैशिष्ट्यपूर्ण मूलद्रव्यांची आता आपण माहिती करून घेऊया.
वैशिष्ट्यपूर्ण मूलद्रव्ये

- सर्वात प्रथम शोधले गेलेले मूलद्रव्य
आवर्तसारणीतील काही मूलद्रव्ये आधीपासूनच माहीत होती. जेव्हा नवीन मूलद्रव्यांचा शोध घेणे सुरु झाले तेव्हा पहिले शोधले गेलेले मूलद्रव्य होते फॉस्फरस

- स्वतःचा वेगळा रंग असणारे धातू
बहुतेक धातू राखाडी रंगाचे दिसतात. परंतू दोन धातूंना त्यांचा स्वतःचा असा वेगळा रंग आहे. ते धातू म्हणजे सोने (Au)सोने सोनेरी रंगाचे असते.

- तांबे (Cu)तांबे लाल रंगाचे असते
द्रवरूपातील मूलद्रव्ये
आवर्तसारणीत स्थायू , द्रव आणि वायू या तिन्ही भौतिक स्थितीतील मूलद्रव्ये आढळतात. सामान्य दाब व तापमानाला स्थायुरुपात असणारी मूलद्रव्ये संख्येने सर्वात जास्त आहेत. मोजकीच मूलद्रव्ये वायुरूपात आहेत. तर दोनच मूलद्रव्ये द्रवरूपात आहेत. ती म्हणजे
पारा (Hg)हा धातू  व ब्रोमीन (Br) हा अधातू
व ब्रोमीन (Br) हा अधातू  .
.
सर्व मूलद्रव्यांमध्ये आपले वेगळेपण जपणारे मूलद्रव्य
वेगवेगळे धातू व अधातू तसेच काही अधातू व अधातू यांच्यात अभिक्रिया होऊन अनेक संयुगे तयार होतात पण असे एक मूलद्रव्य आहे की ज्याची एकट्याचीच संयुगे या सर्व संयुगांपेक्षा संख्येने किती तरी पटींनी जास्त आहेत. ही संयुगे नैसर्गिक तर आहेतच तशीच मानवनिर्मित पण आहेत. शिवाय या संयुगांमध्ये सतत भरच पडत आहे. असे हे वेगळे मूलद्रव्य म्हणजे कार्बन (C). या सर्व संयुगांचा अभ्यास करण्यासाठी रसायन शास्त्रात ऑरगॅनिक केमिस्ट्री (Organic Chemistry) नावाची वेगळी शाखा आहे.
अपरूपे असणारी मूलद्रव्ये
काही मूलद्रव्ये वेगवेगळ्या स्वरूपात आढळतात. यालाच मूलद्रव्यांची अपरूपे (Allotrops) असे म्हणतात. अपरूपे असणारी मूलद्रव्ये आहेत.
कार्बन (C)  , सल्फर (S)
, सल्फर (S) 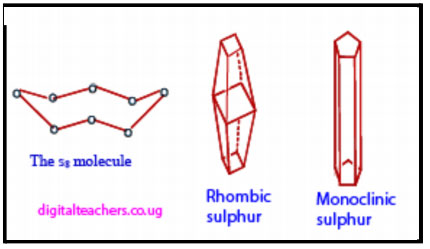 ,
,
फॉस्फरस (P)  , टिन (Sn)
, टिन (Sn) 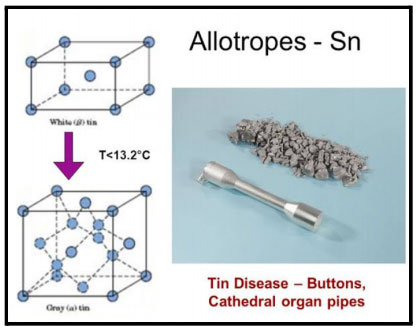
आणि ऑक्सिजन(O) 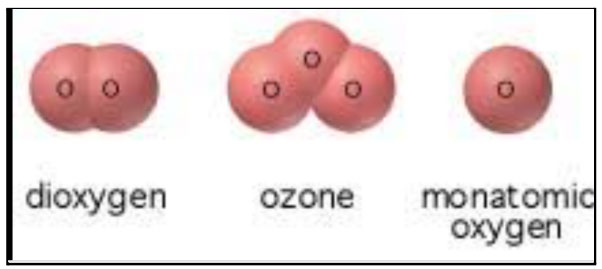 .
.
युरेनियम नंतर ची मूलद्रव्ये
युरेनियम (U92) या मूलद्रव्या नंतर येणारी मूलद्रव्ये निसर्गात सापडत नाहीत. ती सर्व मानवनिर्मित आहेत. शिवाय ती सर्व किरणोत्सर्गी सुद्धा आहेत. यांना युरेनियम नंतरची मूलद्रव्ये (transuranic elements) असे म्हटले जाते.
नावामागे दडलय काय?
या मूलद्रव्यांच्या नावांमधून सुद्धा आपल्याला त्यांच्याबद्दल बरीच माहिती मिळते. याबद्दल एक स्वतंत्र लेख हे ‘का ? व कसे ?’ या उपक्रमात या आधीच आला आहे. तो जरूर वाचा.
आवर्तसारणीतील त्रुटी
आपण आत्तापर्यंत आवर्तसारणी संबंधी बरीच माहिती करून घेतली. मूलद्रव्यांच्या या मांडणीचे महत्व समजून घेतले. असे असले तरी या आवर्तसारणीत सुद्धा काही त्रुटी आहेत. तुमच्या लक्षात आले आहे का? या त्रुटी खालील प्रमाणे:
- आवर्तसारणीतील हायड्रोजनच्या स्थानाबद्दल अजूनही चर्चा होत असते. हायड्रोजन ,अधातू असूनही त्याचे स्थान पहिल्या गणात म्हणजेच अल्कली धातूंच्या गणात आहे.
- आवर्तसारणी द्विमितीत मांडल्यामुळे हॅलोजन, राजवायू व अल्कली धातू यांच्यात असणारी सलगता लक्षात येत नाही. उदा. F9, Ne10, Na11 आणि Cl17, Ar18, K19. म्हणजेच राजवायू च्या मूलद्रव्याच्या अलीकडे क्रियाशील अधातू तर पलीकडे क्रियाशील धातु आहेत. द्विमिती मांडणीमुळे अधातू ते धातू हे राजवायू च्या मार्फत होणारे संक्रमण लक्षात येत नाही.
- आवर्तसारणीत प्रत्येक मूलद्रव्याला त्याच्या गुणधर्मानुसार स्वतंत्र जागा मिळाली आहे. परंतु f खंडातील मूलद्रव्यांना मुख्य आवर्तसारणीत जागा देण्यात आलेली नाही. ही सर्व मूलद्रव्ये आवर्तसारणी च्या मुख्य भागाच्या खाली स्वतंत्रपणे लिहिलेली आहेत. शिवाय ती सर्व एकाच म्हणजे तिसऱ्या गणात आहेत.
असे असले तरी मूलद्रव्यांच्या गुणधर्मांचा अभ्यास करण्यासाठी ही आवर्तसारणी खूपच उपयोगाची आहे. आवर्तसारणीतील वर नमूद केलेल्या त्रुटी दूर करण्याचा प्रयत्न चालूच आहे. त्याबद्दलची माहिती करुन घ्या.
हा लेख वाचल्यावर तुम्हाला काही नवीन माहिती मिळाली का? तुमच्या प्रतिक्रिया जरूर कळवा.
Send us your feedback
All diagrams, pictures, tables etc. are from websites on Internet. We are thankful to all these sources.
Vidnyanvahini is a Non-Governmental Organisation (NGO) and this entire write up is for students, teachers and general public, free of charge.
IT IS NOT FOR ANY COMMERCIAL USE.
